
| A. | ns2 | B. | ns2np1 | C. | ns2np4 | D. | ns2np5 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
| 編號 | 2%CuSO4溶液的體積 | 10%NaOH溶液的體積 | 振蕩后 的現象 | pH | 加乙醛水浴加熱后的沉淀顏色 |
| 1 | 2mL | 3滴 | 淺藍綠色沉淀 | 5~6 | 淺藍綠色沉淀 |
| 2 | a | 15滴 | 淺藍色沉淀 | 7~8 | 黑色沉淀 |
| 3 | 1mL | 1mL | 藍色懸濁沉淀較少 | 9~10 | 紅褐色沉淀 |
| 4 | b | 2mL | 藍色懸濁沉淀較多 | 11~12 | 紅色沉淀 |
| 5 | 1mL | 3mL | 藍紫色溶液 | 12~13 | ---- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
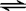 2NH3(g)△H=-92kJ•mol-1
2NH3(g)△H=-92kJ•mol-1查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某校化學興趣小組為探究FeSO4和NaHCO3的反應,按如圖所示操作將NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用經煮沸后冷卻的蒸餾水配制,并在FeSO4溶液中加入少量鐵粉).觀察到試管中立即出現白色沉淀,同時有大量無色氣體生成.
某校化學興趣小組為探究FeSO4和NaHCO3的反應,按如圖所示操作將NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用經煮沸后冷卻的蒸餾水配制,并在FeSO4溶液中加入少量鐵粉).觀察到試管中立即出現白色沉淀,同時有大量無色氣體生成.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
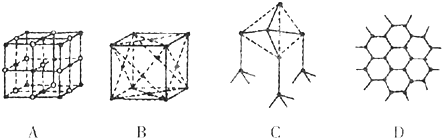
 某研究小組構想將汽車尾氣(NO、NO2)轉化為重要的化工原料HNO3,其原理如圖所示,其中A、B為多孔材料.下列說法正確的是( )
某研究小組構想將汽車尾氣(NO、NO2)轉化為重要的化工原料HNO3,其原理如圖所示,其中A、B為多孔材料.下列說法正確的是( )| A. | 電解質溶液中電流的方向由B到A,電子的流向與之相反 | |
| B. | 電極A表面反應之一為NO-3e-+2H2O═NO${\;}_{3}^{-}$+4H+ | |
| C. | 電極B附近的c(NO${\;}_{3}^{-}$)增大 | |
| D. | 該電池工作時,每轉移4 mol電子,消耗標準狀況O222.4 L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 分別按圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,乙中G為電流計.請回答下列問題:
分別按圖甲、乙所示裝置進行實驗,圖中兩個燒杯里的溶液為同濃度的稀硫酸,乙中G為電流計.請回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com