
分析 方案一:鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣;
(1)鎂的質量分數最小時,金屬鋁的質量最大,需要的氫氧化鈉溶液最多,實際需要氫氧化鈉溶液的體積應大于或等于最大值,據此計算;
(2)鎂上會附著偏鋁酸鈉等物質,未洗滌導致測定的鎂的質量偏大;
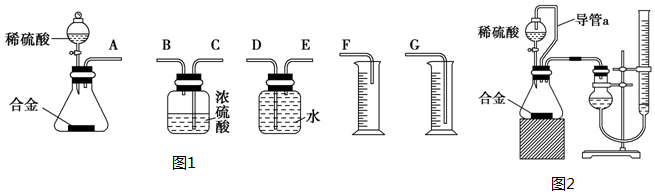
方案二:(1)裝置的組裝順序:合金與水反應,用排水量氣法測定氫氣的體積,其中盛水的試劑瓶導管一定要短進長出,增大壓強原理將水排出,量筒中水的體積就是生成氫氣的體積,量筒內導管應伸入量筒底部;
(2)①保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差;
②滴定管的數值零刻度在上方,兩次的體積之差為測定的氫氣的體積(注意應保持干燥管與滴定管內液面等高),收集氫氣后滴定管內液面上升,讀數減小;
③氣體受溫度和壓強的影響較大,若要確定氣體的物質的量,必須知道實驗時的溫度和壓強.
解答 解:方案一:鋁與氫氧化鈉溶液反應生成偏鋁酸鈉與氫氣,反應方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含鎂為3%時,金屬鋁的含量最高,10.8g合金中鋁的質量為,10.8g×(1-3%)=10.8×97%g,則:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
10.8g×97% V×10-3L×4.0mol/L
所以54g:(10.8g×97%)=2mol:(V×10-3L×4.0mol/L),解得:V=97,
故V(NaOH溶液)≥97mL,
故答案為:97;
(2)鎂上會附著偏鋁酸鈉等物質,未洗滌導致測定的鎂的質量偏大,鎂的質量分數偏高,
故答案為:偏高;
方案二:(1)裝置的組裝順序:合金與水反應,用排水量氣法測定氫氣的體積,其中盛水的試劑瓶導管一定要短進長出,利用增大壓強原理將水排出,量筒中水的體積就是生成氫氣的體積,量筒內導管應伸入量筒底部,故連接順序為:(A)接(E)(D)接(G),
故答案為:E、D、G;
(2)①裝置中導管a的作用是:保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差,
故答案為:保持分液漏斗內氣體壓強與錐形瓶內氣體壓強相等,打開分液漏斗活塞時稀硫酸能順利滴下,滴入錐形瓶的稀硫酸體積等于進入分液漏斗的氣體體積,從而消除由于加入稀硫酸引起的氫氣體積誤差;
②滴定管的數值零刻度在上方,兩次的體積之差為測定的氫氣的體積,收集氫氣后滴定管內液面讀數減小,所以測定氫氣的體積為V1-V2,
故答案為:V1-V2,
③由于氣體受溫度和壓強的影響較大,若要確定氣體的物質的量,必須知道實驗時的溫度和壓強,
故答案為:實驗時的溫度和壓強.
點評 本題考查物質含量的測定、對實驗原理與裝置的理解、實驗方案設計等,難度中等,理解實驗原理是解題的關鍵,是對知識的綜合考查,需要學生具有知識的基礎與綜合運用知識分析問題、解決問題的能力.


科目:高中化學 來源: 題型:實驗題
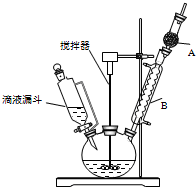 三苯甲醇(C6H5)3C-OH是一種重要的化工原料和醫藥中間體.實驗室合成三苯甲醇的實驗裝置如圖所示.
三苯甲醇(C6H5)3C-OH是一種重要的化工原料和醫藥中間體.實驗室合成三苯甲醇的實驗裝置如圖所示.| 物質 | 沸點/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4C1溶液因水解而顯酸性,故NH4C1是弱電解質 | |
| B. | 純堿溶液因水解而顯堿性,水解的離子方程式為:CO32-+H2O?H2CO3+2OH- | |
| C. | 可樂因含碳酸而顯酸性,電離方程式為:H2CO3?CO32-+2H+ | |
| D. | 配制FeC13 溶液時,先將FeC13 溶于較濃的鹽酸中,然后再加水稀釋到所需濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
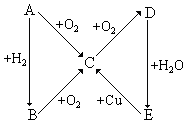 根據如圖所示的A、B、C、D、E五種物質的相互轉化關系,按如下要求填寫相應的物質和有關反應的化學方程式.
根據如圖所示的A、B、C、D、E五種物質的相互轉化關系,按如下要求填寫相應的物質和有關反應的化學方程式.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
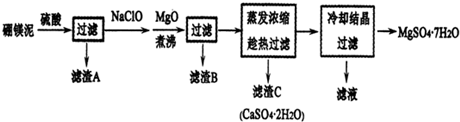
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
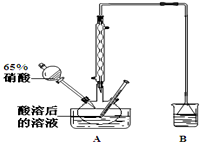 亞硝酸鈉可大量用于染料和有機合成工業.
亞硝酸鈉可大量用于染料和有機合成工業.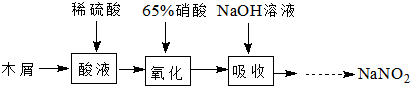
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com