
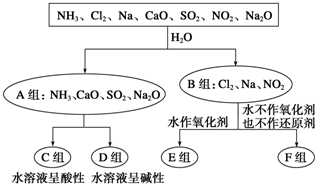
分析 (1)依據圖表變化和物質分類分析變化判斷;
(2)F組與水反應時,水既不是氧化劑又不是還原劑,結合三種物質與水反應的特點判斷.
(3)一水合氨電離出氫氧根離子而使其溶液呈堿性;
(4)氫氧化鋁是兩性氫氧化物溶于強酸強堿;
(5)FeCl3的水溶液滴入沸水可得到以Fe(OH)3膠體,膠體分散質的直徑大小范圍是1~100 nm,據此回答.
解答 解:(1)A組中物質與水發生反應,元素的化合價沒有發生變化,不是氧化還原反應,而B組中物質與水發生氧化還原反應,則A、B的分組從是否發生氧化還原反應的角度分類,
故答案為:是否發生氧化還原反應;
(2)F組與水反應時,水既不是氧化劑又不是還原劑,應為氯氣、二氧化氮與水的反應,與水反應時發生反應的方程式為3NO2+H2O═2HNO3+NO,反應二氧化氮中氮元素化合價既升高也降低,二氧化氮既作氧化劑又作還原劑,故答案為:NO2;
(3)氨水呈弱堿性是因為一水合氨存在電離平衡電離出氫氧根離子,電離方程式為:NH3•H2O?NH4++OH-,故答案為:NH3•H2O?NH4++OH-;
(4)氫氧化鋁是兩性氫氧化物溶于強酸強堿,過量NaOH會溶解生成的沉淀,離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,故答案為:Al(OH)3+OH-=AlO2-+2H2O;(5)①FeCl3的水溶液滴入沸水可得到以Fe(OH)3膠體,膠體分散質的直徑大小范圍是1~100 nm;故答案為:1~100 nm;
②FeCl3的水溶液滴入沸水可得到以Fe(OH)3膠體,生成Fe(OH)3膠體的離子方程式是Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+,故答案為:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+.
點評 本題考查物質的分類和二氧化硫的化學性質以及熱化學方程式的書寫以及蓋斯定律的應用知識,注意知識之間的聯系,難度不大.


 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:選擇題
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-離子數的總和是NA | |
| B. | 室溫下,pH=13的NaOH溶液中含OH-數目為NA | |
| C. | 室溫下,1L pH=12的Ba(OH)2溶液中OH-數目為0.2NA | |
| D. | 室溫下,1L pH=1的鹽酸中,由水電離的H+數目為10-13NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知C2H6的燃燒熱為1090 kJ•mol-1,則C2H6燃燒的熱化學方程式為:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃燒生成CO2和液態水時放出3260 kJ熱量,其熱化學方程式為:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常溫下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,則稀醋酸與稀NaOH溶液反應生成1 mol H2O(l)時也放出57.3 kJ的熱量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,則CO的燃燒熱△H=-283 kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 9.820g晶體中含有C2O42-的物質的量為0.006mol | |
| B. | 配制草酸合鐵酸鉀溶液玻璃儀器只需燒杯和玻璃棒 | |
| C. | 該晶體的化學式為K3Fe(C2O4)3•6H2O | |
| D. | 9.820g樣品中含K+的物質的量為0.06 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.0mol | B. | 2.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com