

分析 (1)CO2物質的量為$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物質的量為0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,發生反應:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物質的量相等,碳酸根離子和碳酸氫根離子水解而使溶液呈堿性,碳酸根離子的水解能力大于碳酸氫根離子;
(2)反應①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反應②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根據蓋斯定律,①+②可得CO2(g)+3H2(g)?CH3OH(g)+H2O(l),反應熱也進行相應計算;
該反應的化學平衡常數K=$\frac{c({CH}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$;
(3)相同時間內,CH4產量越高,反應催化效果越好;
(4)在t1時刻改變一個條件,曲線a變為b,縮短到達平衡的時間,反應速率加快,平衡時CO的濃度不變,改變不影響平衡移動,不可能是升高溫度,反應②是反應前后氣體的物質的量不變的反應,增大壓強平衡不移動,但CO的濃度會增大,可能改變的條件是加入催化劑;
若在t1時刻,將容器體積3L快速壓縮至2L,壓強增大,反應速率加快,縮短到達平衡的時間,不影響平衡移動,平衡時CO的濃度變為$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1時刻瞬間CO的濃度為0.3mol/L;
(5)將BaSO4轉化成BaCO3的離子方程式:BaSO4(s)+CO32-(aq)=BaCO3 (s)+SO42-(aq),該反應的平衡常數K=$\frac{\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}}{\frac{Ksp(BaC{O}_{3})}{c(B{a}^{2+})}}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$.
解答 解:(1)CO2物質的量為$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物質的量為0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,發生反應:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物質的量相等,碳酸根離子和碳酸氫根離子水解而使溶液呈堿性,即c(OH-)>c(H+),碳酸根離子水解生成碳酸氫根離子,所以c(HCO3-)>c(CO32-),由于水解程度較小,所以c(CO32-)>c(OH-),故溶液中各離子濃度大小順序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)反應①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反應②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根據蓋斯定律,①+②可得:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol,
該反應的化學平衡常數K=$\frac{c({CH}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$=2.5×1=2.5,
故答案為:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol;2.5;
(3)由圖可知,在0-15h內,催化劑Ⅱ在相同時間內CH4產量高,對反應催化效果最好的催化劑是Ⅱ,
故答案為:Ⅱ;
(4)在t1時刻改變一個條件,曲線a變為b,縮短到達平衡的時間,反應速率加快,平衡時CO的濃度不變,改變不影響平衡移動,不可能是升高溫度,反應②是反應前后氣體的物質的量不變的反應,增大壓強平衡不移動,但CO的濃度會增大,可能改變的條件是加入催化劑;
若在t1時刻,將容器體積3L快速壓縮至2L,壓強增大,反應速率加快,縮短到達平衡的時間,不影響平衡移動,平衡時CO的濃度變為$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1時刻瞬間CO的濃度為0.3mol/L,畫出變化曲線為: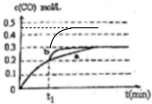 ,
,
故答案為:加入催化劑; ;
;
(5)將BaSO4轉化成BaCO3的離子方程式:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),該反應的平衡常數K=$\frac{\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}}{\frac{Ksp(BaC{O}_{3})}{c(B{a}^{2+})}}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.044,
故答案為:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);0.044.
點評 本題考查平衡常數有關計算、化學平衡計算及影響因素、離子濃度大小比較、熱化學方程式書寫等,題目涉及內容較多,基本屬于拼合型題目,需要學生具備扎實的基礎,難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題


| Fe3+ | Cu2+ | Fe2+ | |
| 開始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 CO和NO是汽車尾氣的主要污染物.消除汽車尾氣的反應式之一為:2NO(g)+2CO(g)?N2(g)+2CO2(g).請回答下列問題:
CO和NO是汽車尾氣的主要污染物.消除汽車尾氣的反應式之一為:2NO(g)+2CO(g)?N2(g)+2CO2(g).請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若不改變其它條件而換用一種更高效的催化劑,則反應達限度的時間會增長 | |
| B. | 達平衡后向容器中只充入O2不能提高反應速率 | |
| C. | 達到平衡時,SO2的轉化率是80% | |
| D. | 將平衡混合氣體通入過量BaCl2溶液中,得到沉淀的質量為114.90g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )是一種食用香料,主要用于配制具有醋栗、桃、草莓、櫻桃、可可、巧克力等各種香氣濃厚的香精.其中一種合成路線如下:
)是一種食用香料,主要用于配制具有醋栗、桃、草莓、櫻桃、可可、巧克力等各種香氣濃厚的香精.其中一種合成路線如下:

 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. +(CH3)2CHCH2OH$→_{△}^{濃硫酸}$
+(CH3)2CHCH2OH$→_{△}^{濃硫酸}$ +H2O,反應類型為酯化反應或取代反應.
+H2O,反應類型為酯化反應或取代反應.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com