
| A. | CH3OH的燃燒熱為192.9kJ/mol | |
| B. | 反應①要吸收熱量,故反應②更實用些 | |
| C. | CH3OH轉變成H2的過程一定要吸收能量 | |
| D. | 根據②推知反應:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
分析 A.燃燒熱是在101kP下,1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量;
B.根據反應①②特點分析;
C.CH3OH轉變成H2可以通過反應①來實現,也可以通過反應②來實現;
D.對于放熱反應,反應物的能量越低,反應放出的熱量越少,則△H越大.
解答 解:A.燃燒熱是在101kP下,1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量,即H元素要轉化為液態水,故甲醇的燃燒熱不是192.9KJ/mol,故A錯誤;
B.反應①甲醇與水反應,且生成氫氣的量較多,則反應①更實用,故B錯誤;
C.CH3OH轉變成H2可以通過反應①來實現,也可以通過反應②來實現,而反應②為放熱反應,故甲醇轉變為氫氣不一定要吸收能量,故C錯誤;
D.1molCH3OH(l)的能量低于1molCH3OH(g)所具有的能量,而對于放熱反應,反應物的能量越低,反應放出的熱量越少,則△H越大,故反應CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ/mol,故D正確;
故選D.
點評 本題考查了熱化學方程式及其應用,題目難度中等,明確蓋斯定律的運用方法、反應熱的大小比較和物質能量的變化判斷是解題關鍵,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | FeC13和MnO2均可加快H2O2分解,同等條件下二者對H2O2分解速率的改變相同 | |
| B. | 其他條件不變,向稀H2SO4與過量Zn的混合物中加少量銅片,既能增大H2生成速率,又能減小生成H2的物質的量 | |
| C. | 其他條件不變,加熱或加壓都能使H2(g)+I2(g)?2HI(g)的v正和v逆同時增大 | |
| D. | v=$\frac{△c}{△t}$是化學上表示化學反應速率的唯一方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
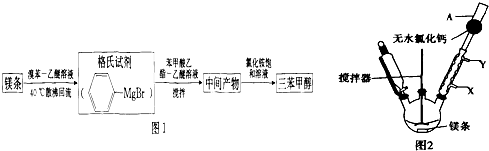
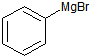 +H2O→
+H2O→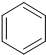 +Mg(OH)Br(堿式溴化鎂)
+Mg(OH)Br(堿式溴化鎂)| 物質 | 熔點 | 沸點 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有機溶劑 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有機溶劑 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多數有機溶劑 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常溫下為固體 | 能溶于水,不溶于醇、醚等有機溶劑 | |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 連二亞硫酸鈉(Na2S2O4),又稱保險粉,是印刷工業中重要的還原劑.某課題小組進行如下實驗:
連二亞硫酸鈉(Na2S2O4),又稱保險粉,是印刷工業中重要的還原劑.某課題小組進行如下實驗:| 實驗步驟(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
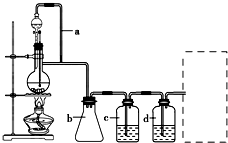 某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:
某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1000mL 2.5mol/L NaCl 溶液 | B. | 300mL 5mol/L KClO3溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 200mL 2mol/L MgCl2 溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol硫酸與1 mol Ba(OH)2完全中和所放出的熱量為中和熱 | |
| B. | 101 kPa時,1 mol碳燃燒所放出的熱量為碳的燃燒熱 | |
| C. | CO是不穩定的氧化物,它能繼續和氧氣反應生成穩定的CO2,所以CO的燃燒反應一定是吸熱反應 | |
| D. | 25℃、101 kPa時,1 mol S和2 mol S的燃燒熱相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | n=2 | |
| B. | 第一次達平衡時,反應消耗的A為0.7 mol | |
| C. | 充入氮氣后,反應速率加快,平衡正向移動 | |
| D. | 正反應放熱 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com