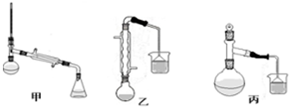
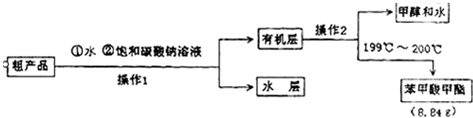
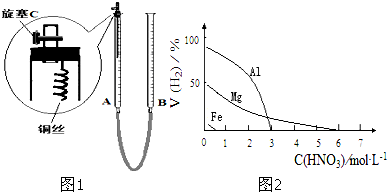
解答:
解:A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大,
A元素的核外電子數和電子層數相等,也是宇宙中最豐富的元素,則A為H元素;
B元素原子的核外p電子數比s電子數少1,則B為N元素;
C原子的第一至第四電離能分別是:I
1=738kJ/mol、I
2=1451kJ/mol、I
3=7733kJ/mol、I
4=10540kJ/mol,該元素第二電離能遠遠小于第三電離能,則C位于第IIA族,其原子序數大于B,則C為Mg元素;
D原子核外所有p軌道上電子全充滿或半充滿,原子序數大于Mg,則D為P元素;
E元素的主族序數與周期數的差為4,E為短周期元素,其原子序數大于D,則其主族族序數VIIA,則E是Cl元素;
F是前四周期中電負性最小的元素,其金屬性最強,為K元素;
G在周期表的第七列且位于第四周期,則G為Mn元素,
(1)NH
5為離子化合物,則該物質為NH
4H,其電子式為
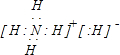
,故答案為:
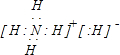
;
(2)N基態原子中能量最高的電子為2p電子,其電子云在空間有3個方向,原子軌道呈啞鈴形,
故答案為:3;啞鈴;
(3)某同學根據上述信息,推斷Mg基態原子的核外電子排布為
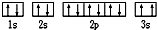
,該同學所畫的電子排布圖違背了泡利原理,故答案為:泡利原理;
(4)Mn位于第VIIB族最后填充的為d電子,為d區元素,價電子排布式為3d
54s
2,
故答案為:ⅦB;d;3d
54s
2;
(5)PCl
3中心原子價層電子對個數是4且含有一個孤電子對,所以P原子的雜化方式為sp
3雜化,用價層電子對互斥理論推測其空間構型為正四面體結構,
故答案為:sp
3;正四面體;
(6)K元素的晶胞如圖所示,該晶胞中K原子個數=1+8×
=2,晶胞的質量=
×2g=
g,若設該晶胞的密度為ag/cm
3,則晶胞的體積=
=
cm
3,則晶胞的棱長=
cm,令F原子的半徑為r cm,晶胞體對角線上的3個F原子相鄰,則:(4r)
2=3(
)
2,r=
,
故答案為:
.

 現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.
現有七種元素,其中A、B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題.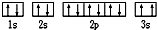 ,該同學所畫的電子排布圖違背了
,該同學所畫的電子排布圖違背了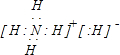 ,故答案為:
,故答案為: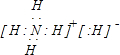 ;
;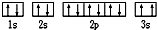 ,該同學所畫的電子排布圖違背了泡利原理,故答案為:泡利原理;
,該同學所畫的電子排布圖違背了泡利原理,故答案為:泡利原理;

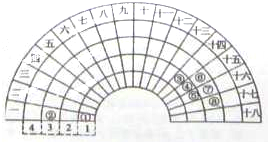 元素周期的形式多種多樣,如圖是扇形元素周期表的一部分,對比中學常見元素周期表,分析其元素的填充規律,判斷下列說法正確的是( )
元素周期的形式多種多樣,如圖是扇形元素周期表的一部分,對比中學常見元素周期表,分析其元素的填充規律,判斷下列說法正確的是( )