
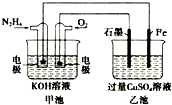
| A. | 甲池中負極上的電極反應式為N2H4-4e-=N2+4H+ | |
| B. | 乙池中石墨電極上發生的反應為4OH--4e-=2H2O+O2↑ | |
| C. | 甲池溶液pH增大,乙池溶液pH減小 | |
| D. | 甲池中每消耗0.1mol N2H4乙池電極上則會析出6.4g固體 |
分析 A、甲池中為原電池反應,N2H4失電子生成氮氣;
B、乙池中為電解反應,石墨電極與正極相連為陽極,氫氧根在陽極失電子發生氧化反應;
C、根據電池的總反應判斷PH的變化;
D、根據電路中每個電極得失電子守恒計算.
解答 解:A、甲池中為原電池反應,負極N2H4-4e-+4OH-=N2+4H2O,故A錯誤;
B、乙池中為電解反應,石墨電極與正極相連為陽極,氫氧根在陽極失電子發生氧化反應,反應式為4OH--4e-=2H2O+O2↑,故B正確;
C、甲池中因反應生成了水會使溶液的pH值減小,乙池中因反應生成了酸也會使溶液的pH值減小,故C錯誤;
D、甲池中每消耗0.1mol N2H4,則根據負極N2H4-4e-+4OH-=N2+4H2O,轉移0.4mol電子,所以乙池電極上則會析出$\frac{0.4mol}{2}$×64g/mol=12.8g銅,故D錯誤.
故選B.
點評 本題考查了原電池、電解池工作的基本原理,以及原電池電極反應式的書寫,題目難度中等,注意把握原電池和電解池中電極方程式的書寫方法.


科目:高中化學 來源: 題型:選擇題
| A. | 將pH=5的醋酸溶液稀釋后,恢復至原溫度,pH和Kw均增大 | |
| B. | 25℃時,pH=3的氯化銨溶液中:c(OH-)=1.0×10-11mol•L-1 | |
| C. | 25℃時,pH=4的氯化銨溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向NH4HSO4溶液中加入等物質的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KMnO4 | B. | KClO3 | C. | MnO2 | D. | Ca(ClO)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上用水吸收NO2生產硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工業原料氯化銨中的氯化鐵雜質:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰處理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明礬除去水中的懸浮顆粒物:Al3++3H2O?Al(OH)3(膠體)+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用環形玻璃攪拌棒是為了加快反應速率,使其充分反應,減小實驗誤差 | |
| B. | 為了準確測定反應混合溶液的溫度,實驗中溫度計水銀球應與小燒杯底部接觸 | |
| C. | 為了使反應均勻進行,可以向酸(堿)中分次加入堿(酸) | |
| D. | 在測定中和熱實驗中需要使用的儀器有量筒、燒杯、膠頭滴管、溫度計等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 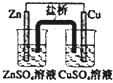 如裝置中,鹽橋中的K+移向CuSO4溶液 | |
| B. | 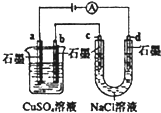 如圖裝置中b極析出6.4g固體時,d極產生2.24LH2 | |
| C. | 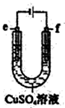 用如圖裝置精煉銅時,f極為粗銅 | |
| D. | 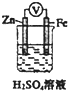 如圖裝置中電子沿導線由Zn流向Fe,Fe極上有大量氣泡生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑 Na<Mg<Al | B. | 酸性 H2SiO3<H2CO3<H2SO4 | ||
| C. | 穩定性 HF<HCl<HBr | D. | 堿性 NaOH<Mg(OH)2<Al(OH)3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②④⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com