
分析 (1)已知某反應的平衡常數(shù)K=$\frac{[C{O}_{2}]^{2}}{[S{O}_{2}]•[CO]^{2}}$,則該反應的方程式為SO2(g)+2CO(g)?2CO2(g)+S(s),根據(jù)蓋斯定律結合已知方程式計算反應熱;
(2)根據(jù)所給反應的平衡常數(shù),利用三段式法計算濃度變化值結合公式計算;
(3)學反應達到化學平衡狀態(tài)時,正逆反應速率相等,且不等于0,各物質的濃度不再發(fā)生變化,由此衍生的一些物理量不發(fā)生變化,以此進行判斷;
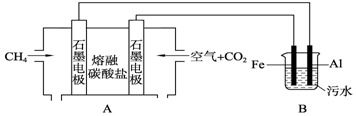
(4)①甲烷燃料電池中正極上氧氣得電子;電解池中陽極上Fe失電子生成亞鐵離子;
②該裝置中一個閉合回路,各個電極流過的電量相等,根據(jù)電子守恒可計算甲烷的體積.
解答 解:(1)已知某反應的平衡常數(shù)K=$\frac{[C{O}_{2}]^{2}}{[S{O}_{2}]•[CO]^{2}}$,則該反應的方程式為SO2(g)+2CO(g)?2CO2(g)+S(s),
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol -1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol -1
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol -1,
由蓋斯定律①-②-③可得SO2(g)+2CO(g)?2CO2(g)+S(s)△H=-270kJ•mol-1;
故答案為:SO2(g)+2CO(g)?2CO2(g)+S(s)△H=-270kJ•mol-1;
(2)設參加反應的CO的濃度為x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始濃度(mol/L)0.30 0.30 0 0
轉化濃度(mol/L) x x x x
轉化濃度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{[C{O}_{2}]•[{H}_{2}]}{[CO]•[{H}_{2}O]}$=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,所以CO的轉化率α(CO)=$\frac{0.225}{0.30}$×100%=75%,氫氣反應速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol/(L•min),
故答案為:75%;0.045mol/(L•min);
(3)a.反應前后氣體的體積不等,故容器總壓強隨時間改變,當壓強不再隨著時間變化時,即時達到化學平衡狀態(tài),故a正確;
b.總質量不變,體積不變,故混合氣體的密度始終不變,所以不能作為判斷是否達到化學平衡狀態(tài)的依據(jù),故b錯誤;
c.SO2和O2的物質的量之比,與起始的物質的量以及轉化率有關,若起始的物質的量之比為2:1,則SO2和O2的物質的量之比始終不變,所以不能作為判斷是否達到化學平衡狀態(tài)的依據(jù),故c錯誤;
d.每消耗1mol SO3為逆速率,同時,生成0.5mol O2為正速率,不同物質表示的正逆速率之比等于計量數(shù)之比即時平衡狀態(tài),故d正確;
故答案為:ad;
(4)①甲烷燃料電池中正極上氧氣得電子,正極的電極反應為O2+2CO2+4e-=2CO32-;電解池中陽極上Fe失電子生成亞鐵離子,則陽極上的電極反應為:Fe-2e-=Fe2+;
故答案為:O2+2CO2+4e-=2CO32-;Fe-2e-=Fe2+;
,故答案為:CH4+4CO32--8e-=5CO2↑+2H2O;
②該裝置中一個閉合回路,各個電極流過的電量相等,則有關系式CH4~8e-~4H2,所以當陰極產生了22.4L(標準狀況)氫氣時,熔融鹽燃料電池消耗標準狀況下CH4的體積為22.4L×$\frac{1}{4}$=5.6L,
故答案為:5.6.
點評 本題主要考查反應速率的計算、轉化率的計算、影響化學反應速率、化學平衡的因素、蓋斯定律、原電池、電解池等知識,難度中等,答題時注意化學原理的基礎知識的靈活運用.


科目:高中化學 來源: 題型:選擇題
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
| pH | 11 | 11 | 3 | 3 |
| A. | 分別加水稀釋10倍、四種溶液的pH:①>②>④>③ | |
| B. | 溫度下降10℃,四種溶液的pH均不變 | |
| C. | 在①、②中分別加入適量的氯化銨晶體后,①的pH減小,②的pH不變 | |
| D. | 將①、④兩種溶液等體積混合,所得溶液中:c(Cl-)<c(NH4+)<c(H+)<c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中I-濃度減小 | B. | 溶度積常數(shù)Ksp增大 | ||
| C. | 沉淀溶解平衡向左移動 | D. | 溶液中Pb2+濃度增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氟離子易與鈦離子形成可溶性難電離物質 | |
| B. | 氫氟酸的氧化性比其他酸強 | |
| C. | 氫氟酸的還原性比其他酸強 | |
| D. | 氫氟酸的酸性比其他酸強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 通入稀有氣體使壓強增大,平衡不移動 | |
| B. | 增大壓強同時又升高溫度,反應速率加快且可以提高Z 的產率 | |
| C. | 降低溫度,混合氣體的平均相對分子質量變大 | |
| D. | 增加X的物質的量,Y的轉化率增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
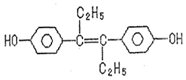
| A. | 可與NaOH和NaHCO3發(fā)生反應 | |
| B. | 可以用有機溶劑萃取 | |
| C. | 1mol該有機物可以與5molBr2發(fā)生反應 | |
| D. | 該有機物分子中,可能有18個碳原子共平面 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com