

| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| 0.8×1 |
| 0.42 |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| C 2(CH3OH) |
| 1.2×0.6 |
| 0.42 |


 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:
| A、0.1mol/L MgCl2溶液中Cl-離子數為0.2NA |
| B、19.2g銅與足量的稀硝酸反應產生NO的體積為4.48L |
| C、標準狀況下,33.6L H2O含有9.03×1023個H2O分子 |
| D、46g NO2和N2O4的混合物中原子總數為3NA個 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
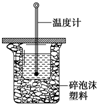 50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| Cu |
查看答案和解析>>
科目:高中化學 來源: 題型:
 有A、B兩個容器,A為恒壓容器,B為恒容容器.在相同溫度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此時VA=2VB.維持溫度不變,A、B中的反應均達到平衡.平衡時,兩容器中反應放出的熱量分別為QAkJ、QBkJ,A容器中氣體體積為起始時的
有A、B兩個容器,A為恒壓容器,B為恒容容器.在相同溫度下A中充入1molN2、3molH2,B中充入0.5molN2、1.5molH2.此時VA=2VB.維持溫度不變,A、B中的反應均達到平衡.平衡時,兩容器中反應放出的熱量分別為QAkJ、QBkJ,A容器中氣體體積為起始時的| 4 |
| 5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com