
| A. | HX是弱酸 | B. | 離子濃度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 電離常數:K(HZ)>K(HY) | D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
分析 常溫下,0.1mol/L的三種鹽溶液NaX、NaY、NaZ的pH分別為7、8、9,可知NaX是強酸強堿鹽,NaY、NaZ均為弱酸弱堿鹽,且根據“越弱越水解”可知,由于NaY溶液的堿性弱于NaZ,故HY的酸性強于HZ,即可知酸性強弱為HX>HY>HZ.據此分析.
解答 解:常溫下,0.1mol/L的三種鹽溶液NaX、NaY、NaZ的pH分別為7、8、9,可知NaX是強酸強堿鹽,NaY、NaZ均為弱酸弱堿鹽,且根據“越弱越水解”可知,由于NaY溶液的堿性弱于NaZ,故HY的酸性強于HZ,即可知酸性強弱為HX>HY>HZ.
A、0.1mol/L的NaX溶液pH=7,溶液顯中性,故為強酸強堿鹽,則HX為強酸,故A錯誤;
B、由于酸性強弱為HX>HY>HZ,而酸越弱,則對應的酸根離子越水解,故濃度均為0.1mol/L的三種鹽溶液NaX、NaY、NaZ中,離子濃度:c(Z-)<c(Y-)<c(X-),故B錯誤;
C、由于HY和HZ均為一元弱酸,且酸性HY>HZ,而酸性越強,電離平衡常數越大,故電離常數:K(HY)>K(HZ),故C錯誤;
D、由于HX為強酸,故X-不水解,在NaX中,c(X-)=0.1mol/L;而HY和HZ均為弱酸,故在NaY和NaZ中,Y-和Z-均水解,根據物料守恒可知:c(Y-)+c(HY)=c(Z-)+c(HZ)=0.1mol/L,故有:c(Y-)+c(HY)=c(Z-)+c(HZ)=c(X-)=0.1mol/L,故D正確.
故選D.
點評 本題考查鹽類的水解,題目難度中等,注意酸根離子水解程度越大,對應的酸越弱.


科目:高中化學 來源: 題型:選擇題
| A. | pH在5.6~7.0之間的降水通常稱為酸雨 | |
| B. | 新制氯水經光照一段時間pH增大 | |
| C. | 燃煤時加入適量生石灰,可減少廢氣中SO2的量 | |
| D. | 測定某溶液pH應先用蒸餾水潤濕pH試紙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 55 g•mol-1 | B. | 96 g•mol-1 | C. | 108 g•mol-1 | D. | 110 g•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
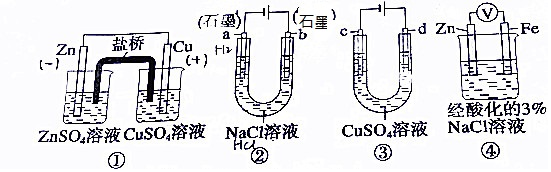
| A. | 裝置①中,鹽橋中的K+移向ZnSO4溶液 | |
| B. | 裝置②工作一段后,a極附近的溶液pH增大,滴加酚酞為紅色 | |
| C. | 用裝置③精煉銅時,c極為粗銅 | |
| D. | 裝置④中電子由Zn流向Fe,加入K3[Fe(CN)6]溶液產生藍色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 肯定有電子得失 | |
| B. | 肯定是有關氧元素的反應 | |
| C. | 肯定有化合價的變化 | |
| D. | 氧化劑得到電子總數與還原劑失去電子總數相等 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com