
| |||||||||||||||||||||||||||||
(1) |
|
(2) |
在H2O2、KMnO4、NaClO、K2Cr2O7中,只能氧化Fe2+的是H2O2,KMnO4、NaClO、K2Cr2O7既能氧化Fe2+,又能氧化Cl-. |
(3) |
|
(4) |
答案:A、B、D、G、I,玻璃棒 解析:分離出沉淀Z[Fe(OH)3]的實驗操作是過濾,使溶液里的Cu2+、Cl-轉(zhuǎn)化為CuCl2·2H2O晶體的操作叫做蒸發(fā)結(jié)晶.這是選擇實驗儀器的根據(jù). |
|
(學(xué)法指導(dǎo))解該題的難點在于對“完全呈氫氧化物沉淀所需的pH:Fe3+為3.7、Cu2+為6.4、Fe2+為6.4”的理解與應(yīng)用.請參考“解析”加強理解. |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學(xué) 來源: 題型:

查看答案和解析>>
科目:高中化學(xué) 來源:江蘇省啟東中學(xué)2012屆高三上學(xué)期期中考試化學(xué)試題 題型:058
從回收的含銅電纜廢料中提取銅時,假若設(shè)計如下兩種方案,回答有關(guān)問題.
方案甲:
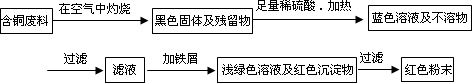
方案乙:

(1)兩個方案中,符合當(dāng)前生產(chǎn)中綠色化學(xué)理念的是方案________,理由是________.
(2)方案乙中銅溶解生成藍色溶液時發(fā)生反應(yīng)的離子方程式為________,
若不考慮綠色化學(xué)要求,溶解銅生成硫酸銅時,還可將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使銅溶解完全,則理論上硫酸和硝酸的物質(zhì)的量之比最佳為:________∶________.
(3)為了提高原料的利用率,最后一步所得淺綠色濾液通過蒸發(fā)濃縮、冷卻結(jié)晶、過濾、洗滌、自然干燥可得到一種結(jié)晶水合物的晶體.獲得晶體后對其進行檢測:
①先取a g的晶體進行脫水實驗,獲得無水固體為(a-1.26)g
②將無水固體溶于足量的水配成溶液后滴加1.00 mol/L的氯化鋇溶液,當(dāng)?shù)渭?0.00 mL溶液時,沉淀恰好完全.通過計算測知該晶體的化學(xué)式是________.
(4)氯化亞銅(CuCl)是重要的化工原料.國家標(biāo)準(zhǔn)規(guī)定合格的CuCl產(chǎn)品的主要質(zhì)量指標(biāo)為CuCl的質(zhì)量分數(shù)大于96.5%.工業(yè)上用硫酸銅等原料常通過下列反應(yīng)制備CuCl:2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
測定CuCl質(zhì)量分數(shù)時先準(zhǔn)確稱取所制備的0.2500 g CuCl樣品置于一定量的0.5 mol·L-1 FeCl3溶液中,待樣品完全溶解后,加水20 mL,用0.1000 mol·L-1 Ce(SO4)2溶液滴定到終點,消耗24.60 mL Ce(SO4)2溶液.有關(guān)反應(yīng)的離子方程式為:Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe2+=Fe3++Ce3+通過計算說明上述樣品中CuCl的質(zhì)量分數(shù)是否符合標(biāo)準(zhǔn).
查看答案和解析>>
科目:高中化學(xué) 來源:2012-2013學(xué)年江蘇省南通市海安縣高二上學(xué)期期末考試化學(xué)試卷(帶解析) 題型:實驗題
(14分)氯化銅晶體(CuCl2·xH2O)是重要的化工原料,可用作催化劑、消毒劑等。用孔雀石[主要含Cu2(OH)2CO3,還含少量Fe、Si的化合物]制備氯化銅晶體,方案如下: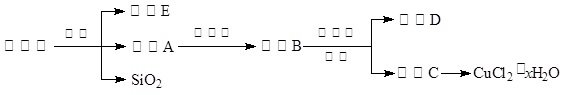
已知:有關(guān)金屬離子從開始沉淀到沉淀完全時溶液的pH: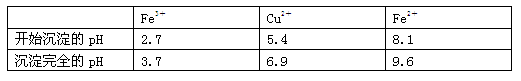
⑴酸溶時,為了提高浸取率可采取的措施有 。(寫出一點)
⑵若溶液A含有的金屬離子有Cu2+、Fe2+,則試劑①為Cl2,通入Cl2發(fā)生反應(yīng)的離子方程式: 。
⑶加入試劑②的目的是調(diào)節(jié)pH至a,a的范圍是 ;
為避免引入雜質(zhì)離子,試劑②可選用 。
| A.氨水 | B.氧化銅 | C.氫氧化銅 | D.氫氧化鈉 |
查看答案和解析>>
科目:高中化學(xué) 來源:2014屆江蘇省高三上學(xué)期第一次月考化學(xué)試卷(解析版) 題型:填空題
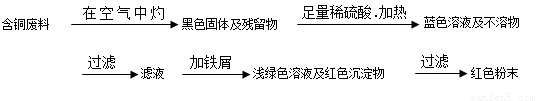
從回收的含銅電纜廢料中提取銅時,假若設(shè)計如下兩種方案,回答有關(guān)問題。
方案甲:
方案乙:
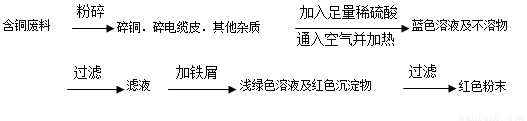
(1)兩個方案中,符合當(dāng)前生產(chǎn)中綠色化學(xué)理念的是方案 ,理由是 方案第一步“灼燒”會產(chǎn)生污染空氣的氣體、粉塵、煙霧。
(2)方案乙中銅溶解生成藍色溶液時發(fā)生反應(yīng)的離子方程式為________________ _ ______。
(3)為了提高原料的利用率,最后一步所得淺綠色濾液通過蒸發(fā)濃縮、冷卻結(jié)晶、過濾、洗滌、自然干燥可得到一種結(jié)晶水合物的晶體。獲得晶體后對其進行檢測:
①先取a g的晶體進行脫水實驗,獲得無水固體為(a—1.26)g
②將無水固體溶于足量的水配成溶液后滴加1.00mol/L的氯化鋇溶液,當(dāng)?shù)渭?0.00mL溶液時,沉淀恰好完全。通過計算測知該晶體的化學(xué)式是 。
(4)氯化亞銅(CuCl)是重要的化工原料。國家標(biāo)準(zhǔn)規(guī)定合格的CuCl產(chǎn)品的主要質(zhì)量指標(biāo)為CuCl的質(zhì)量分數(shù)大于96.5% 。工業(yè)上用硫酸銅等原料常通過下列反應(yīng)制備CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑
測定CuCl質(zhì)量分數(shù)時先準(zhǔn)確稱取所制備的0.2500g CuCl樣品置于一定量的0.5mol·L-1 FeCl3 溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到終點,消耗24.60mL Ce(SO4)2溶液。有關(guān)反應(yīng)的離子方程式為:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ =Fe 3+ + Ce3+
計算上述樣品中CuCl的質(zhì)量分數(shù)為 。
查看答案和解析>>
科目:高中化學(xué) 來源:2014屆江蘇省南通市海安縣高二上學(xué)期期末考試化學(xué)試卷(解析版) 題型:實驗題
(14分)氯化銅晶體(CuCl2·xH2O)是重要的化工原料,可用作催化劑、消毒劑等。用孔雀石[主要含Cu2(OH)2CO3,還含少量Fe、Si的化合物]制備氯化銅晶體,方案如下:
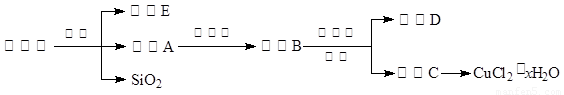
已知:有關(guān)金屬離子從開始沉淀到沉淀完全時溶液的pH:
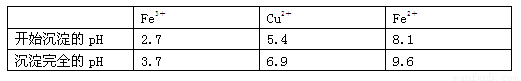
⑴酸溶時,為了提高浸取率可采取的措施有 。(寫出一點)
⑵若溶液A含有的金屬離子有Cu2+、Fe2+,則試劑①為Cl2,通入Cl2發(fā)生反應(yīng)的離子方程式: 。
⑶加入試劑②的目的是調(diào)節(jié)pH至a,a的范圍是 ;
為避免引入雜質(zhì)離子,試劑②可選用 。
A.氨水 B.氧化銅 C.氫氧化銅 D.氫氧化鈉
⑷由溶液C獲得CuCl2·xH2O,實驗操作依次是加熱濃縮、冷卻結(jié)晶、過濾和洗滌等操作。加熱濃縮過程需加入少量鹽酸的目的是: 。
⑸工業(yè)生產(chǎn)過程會產(chǎn)生含Cu2+的廢水,向廢水加入堿調(diào)節(jié)pH=8,沉降后廢水中Cu2+濃度為 mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亞銅(CuCl)也是一種重要的化工原料。
制備過程:向CuCl2溶液中通入一定量的SO2,加熱一段時間后生成CuCl白色沉淀。寫出制備CuCl的離子方程式: 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com