
| A. | 常溫下,等濃度的氯化銨和氟化銨溶液中銨離子濃度前者大 | |
| B. | CH3COOH溶液加水稀釋后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值減小 | |
| C. | 常溫下,pH相等的醋酸鈉和碳酸氫鈉溶液前者的物質的量濃度較大 | |
| D. | 常溫下,NaClO溶液中:c(HClO)+c(ClO-)=c(Na+) |
分析 A.氟化銨中氟離子和銨根離子都水解,而氯化銨中只有銨根離子水解;
B.稀釋過程中氫離子的物質的量增大,而醋酸分子的物質的量減小;
C.醋酸根離子的水解程度小于碳酸氫鈉,濃度相等時醋酸鈉溶液的pH小于碳酸氫鈉,據此判斷pH相同時二者濃度大小;
D.根據次氯酸鈉溶液中的物料守恒判斷.
解答 解:A.由于氟化銨中氟離子和銨根離子都水解,而氯化銨中只有銨根離子水解,則氯化銨溶液中的離子濃度大于氟化銨,故A正確;
B.醋酸在稀釋過程中,醋酸的電離程度增大,則氫離子的物質的量增大,而醋酸分子的物質的量減小,由于在同一溶液中,則$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$的值增大,故B錯誤;
C.醋酸鈉的水解程度小于碳酸氫鈉,相同濃度時醋酸鈉溶液的pH小于碳酸氫鈉,則pH相同時醋酸鈉的濃度大于碳酸氫鈉,故C正確;
D.根據NaClO溶液中的物料守恒可得:c(HClO)+c(ClO-)=c(Na+),故D正確;
故選B.
點評 本題考查了離子濃度大小比較、鹽的水解原理及其應用、弱電解質的電離,題目難度中等,注意掌握弱電解質的電離平衡及其影響,明確鹽的水解原理、物料守恒在判斷離子濃度大小中的應用方法.


科目:高中化學 來源: 題型:解答題
 ;Y和E兩元素中第一電離能較大的是(填元素符號)F;X、Y、Q三元素可以形成一種化合物,它與稀鹽酸反應的離子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.
;Y和E兩元素中第一電離能較大的是(填元素符號)F;X、Y、Q三元素可以形成一種化合物,它與稀鹽酸反應的離子方程式是:CaCO3+2H+=Ca2++CO2↑+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 混合物里三種物質反應時消耗鹽酸的物質的量之比為1:1:3 | |
| B. | 反應后所得溶液中的Fe2+離子與Cl-離子的物質的量之比為1:2 | |
| C. | 混合物里,FeO的物質的量無法確定,但Fe和Fe2O3的物質的量一樣多 | |
| D. | 混合物里,Fe2O3的物質的量無法確定,但Fe比FeO的物質的量多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 營養素 | 每100g含有 |
| 蛋白質 | 4.8g |
| 油脂 | 20g |
| 糖類 | 40g |
| -胡蘿卜素 (維生素類) | 1.8g |
| 碳酸鈣 | 400mg |
| A. | 油脂是高級脂肪酸的甘油酯 | |
| B. | 糖類是產生能量最高的營養物質 | |
| C. | 糖類、油脂、蛋白質都是高分子化合物 | |
| D. | 蛋白質在人體內水解最終生成二氧化碳和水 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 用CO表示反應速率 | B. | 平衡混合氣體的平均相對分子質量 | ||
| C. | CO的轉化率 | D. | CO2的體積分數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 1mol奎尼酸與足量鈉反應生成56L氫氣 | |
| B. | 奎尼酸能使溴的四氯化碳溶液褪色 | |
| C. | 與乙醇、乙酸均能發生取代反應 | |
| D. | 不能用碳酸氫鈉溶液鑒別奎尼酸和苯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ,畫出C元素的原子結構示意圖
,畫出C元素的原子結構示意圖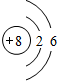 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com