
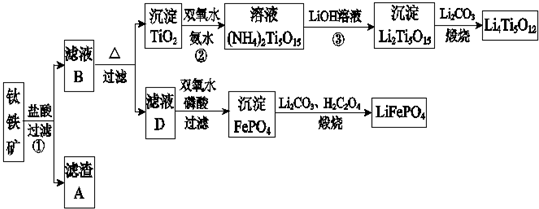
分析 鐵礦石加入鹽酸溶解過濾得到濾渣為二氧化硅,濾液B為MgCl2、CaCl2,FeCl2、TiOCl42-,加熱促進水解,過濾得到沉淀TiO2,加入過氧化氫和氨水反應得到(NH4)2Ti5O15,加入氫氧化鋰溶液得到沉淀Li2Ti5O15,加入碳酸鋰煅燒得到鈦酸鋰Li4Ti5O12,濾液D加入過氧化氫氧化亞鐵離子,加入磷酸得到沉淀磷酸鐵,加入碳酸鋰和草酸煅燒得到磷酸亞鐵鋰LiFePO4.
(1)根據反應FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是氧化還原反應,可以判斷鐵元素化合價為+2價;
(2)MgO、CaO、SiO2等雜質中,二氧化硅不溶于稀鹽酸,成為濾渣A;
(3)根據流程圖示,TiOCl42-在溶液中加熱與水反應生成二氧化鈦沉淀;
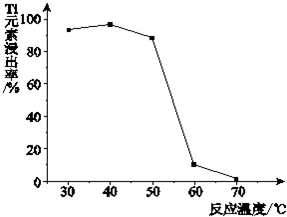
(4)二氧化鈦與氨水、雙氧水反應生成NH4)2Ti5O15,溫度過高,雙氧水和氨水都容易分解;
(5)濾液D加入過氧化氫氧化亞鐵離子,加入磷酸得到沉淀FePO4;
(6)根據電子守恒找出雙氧水與草酸的關系式,然后列式計算計算出17%雙氧水與H2C2O4的質量比;
(7)充電時按照電解槽進行分析,陽極氧化陰極還原,寫出陽極放電的電解方程式即可.
解答 解:(1)反應FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是氧化還原反應,可以判斷鐵元素化合價為+2價,
故答案為:+2;
(2)由于雜質中二氧化硅不溶于鹽酸,所以濾渣A成分是二氧化硅,
故答案為:SiO2;
(3)根據流程可知,TiOCl42-在溶液中加熱與水反應生成二氧化鈦沉淀,反應的離子方程式為:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案為:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化鈦與氨水、雙氧水反應生成NH4)2Ti5O15時,溫度過高,雙氧水和氨水都容易分解,所以反應溫度過高時,Ti元素浸出率下降,
故答案為:溫度過高時,反應物氨水(或雙氧水)受熱易分解;
(5)根據流程圖示可知,濾液D加入過氧化氫氧化亞鐵離子,加入磷酸得到沉淀FePO4,反應的離子方程式為:2H3PO4+H2O2+2Fe2+═2FePO4↓+2H2O+4H+,
故答案為:2H3PO4+H2O2+2Fe2+═2FePO4↓+2H2O+4H+;
(6)根據電子守恒,氧化鐵元素轉移的電子就等于鐵離子氧化草酸轉移的電子數,
因此可得關系式:H2O2~H2C2O4,設雙氧水質量為x,草酸質量為y,
34 90
x×17% y
34y=90×x×17%,x:y=20:9,17%雙氧水與H2C2O4的質量比為20:9,
故答案為:20:9;
(7)充電時,陽極發生氧化反應,LiFePO4失去電子生成FePO4,電極反應為:LiFePO4-e-=FePO4+Li+,
故答案為:LiFePO4-e-=FePO4+Li+.
點評 本題借助利用鈦鐵礦制備鋰離子電池電極材料流程,為高頻考點和高考常見題型,考查了離子方程式書寫、電極方程式書寫、化學計算等知識,涉及的內容較多,綜合性較強,充分考查了學生的綜合能力,本題難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 元素周期律是按相對原子質量逐漸增大的順序從左到右排列的 | |
| B. | 最外層電子數相同的元素都是同一族 | |
| C. | 同周期元素原子的電子層數相同數一定相同 | |
| D. | 非金屬元素的最外層電子數都大于或等于4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯與溴能發生取代反應,因此不能用苯萃取溴水中的溴 | |
| B. | 相同質量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃燒,耗氧量一樣多 | |
| C. | 乙烯和聚乙烯都能發生加成反應 | |
| D. | 為了防止蛋白質鹽析,疫苗等生物制劑應冷凍儲存 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
 紙置于陽極附近,若試紙變藍則證明有Cl2生成.
紙置于陽極附近,若試紙變藍則證明有Cl2生成.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硬脂酸甘油酯屬于高級脂肪酸甘油酯,是高分子化合物 | |
| B. | 含淀粉或纖維素的物質可以制造酒精 | |
| C. | 雞蛋清的溶液中加入硫酸銅溶液,雞蛋清凝聚,蛋白質變性 | |
| D. | 不同種類的氨基酸能以不同的數目和順序彼此結合,形成更復雜的多肽化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO3溶液中投入過氧化鈉粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | ||||||
| B. | AlCl3溶液與燒堿溶液反應,當n(OH-):n(Al3+)=7:2時,離子方程式為:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | ||||||
| C. | 鈉與CuSO4溶液反應:2Na+Cu2+═Cu↓+2Na+ | ||||||
| D. | 碳酸和次氯酸的電離平衡常數見表,二氧化碳通入次氯酸鈉溶液中:2NaClO+CO2+H2O═Na2CO3+2HClO
|
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com