

分析 X能與鹽酸、氫氧化鈉反應都生成氣體,應為弱酸銨鹽,與鹽酸反應得到氣體A,A能與過氧化鈉反應生成氣體D,則A為CO2、D為O2,X與氫氧化鈉反應得到氣體C為NH3,A與C物質的量之比為1:1,且B為常見液體,可以推知X為NH4HCO3、B為H2O,C(氨氣)與D(氧氣)反應生成E為NO,E與氧氣反應生成F為NO2,F與水反應得到G能與Cu反應生成NO、NO2,則G為HNO3,據此解答.
解答 解:X能與鹽酸、氫氧化鈉反應都生成氣體,應為弱酸銨鹽,與鹽酸反應得到氣體A,A能與過氧化鈉反應生成氣體D,則A為CO2、D為O2,X與氫氧化鈉反應得到氣體C為NH3,A與C物質的量之比為1:1,且B為常見液體,可以推知X為NH4HCO3、B為H2O,C(氨氣)與D(氧氣)反應生成E為NO,E與氧氣反應生成F為NO2,F與水反應得到G能與Cu反應生成NO、NO2,則G為HNO3,
(1)由上述分析可知,F是NO2,X是NH4HCO3,
故答案為:NO2;NH4HCO3;
(2)Cu與硝酸反應生成硝酸銅與氮的氧化物,反應中N元素的化合價部分為不變化,部分降低,故硝酸表現酸性、氧化性,
故答案為:酸性和氧化性;
(3)NH4HCO3與過量NaOH溶液反應的離子方程式為:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO+NH3↑,
故答案為:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO+NH3↑;
(4)C→E反應的化學方程式:4 NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O,
故答案為:4 NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O;
(5)以NH3、H2O、O2為原料可生產HNO3,使a mol NH3完全轉化為HNO3,根據電子轉移守恒,理論上至少需要氧氣的物質的量=$\frac{amol×[5-(-3)]}{4}$=2a mol,
故答案為:2a;
(6)C與G的反應產物為硝酸銨,含有的陽離子為NH4+,檢驗NH4+的方法:取少量樣品于試管中,加入氫氧化鈉并加熱,把濕潤的紅色石蕊試紙放在試管口,試紙變藍,說明含有NH4+,
故答案為:取少量樣品于試管中,加入氫氧化鈉并加熱,把濕潤的紅色石蕊試紙放在試管口,試紙變藍,說明含有NH4+.
點評 本題考查無機物推斷,難度中等,注意根據X既能與鹽酸又能與氫氧化鈉反應生成氣體及A能與過氧化鈉反應生成氣體進行推斷,(5)中注意利用電子轉移守恒解答.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 最近,科學家從石墨中分離出來的石墨烯是已知最薄、最堅硬的物質.可以制成納米材料.其結構如圖所示:下列關于石墨烯的說法正確的是( )
最近,科學家從石墨中分離出來的石墨烯是已知最薄、最堅硬的物質.可以制成納米材料.其結構如圖所示:下列關于石墨烯的說法正確的是( )| A. | 屬于高分子化合物 | B. | 與金剛石互為同分異構體 | ||
| C. | 性質穩定不能與氧氣等物質反應 | D. | 能導電 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用10mL量筒量取8.10mL稀鹽酸 | |
| B. | 用pH計測得某溶液的pH為2.3 | |
| C. | 用pH試紙測定溶液的pH時,需先用蒸餾水潤濕試紙 | |
| D. | 可用50.00mL堿式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往某溶液中滴加BaCl2溶液,產生白色沉淀,則原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸銀溶液,產生白色沉淀,則原溶液中一定含Cl- | |
| C. | 取某溶液進行焰色反應,透過藍色鈷玻璃焰色為紫色,則原溶液的溶質一定是鉀鹽 | |
| D. | 往某溶液中通入CO2,產生白色沉淀,則原溶液中一定含SiO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水玻璃可用于生產黏合劑和防火劑 | |
| B. | 誤服重金屬鹽,立即服用牛奶或豆漿可解毒 | |
| C. | 油脂、乙酸乙酯都屬于酯類,但不是同系物 | |
| D. | 蔗糖、淀粉、纖維素水解的最終產物都只是葡萄糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
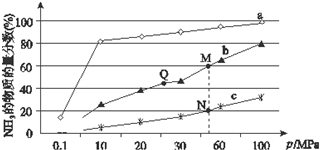 合成氨反應是化學上最重要的反應之一:
合成氨反應是化學上最重要的反應之一:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com