
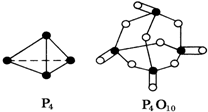
 化學反應過程中發(fā)生物質變化的同時,常常伴有能量的變化,這種能量的變化常以熱能的形式表現(xiàn)出來,叫做反應熱.由于反應的情況不同,反應熱可以分為許多種,如燃燒熱和中和熱等.
化學反應過程中發(fā)生物質變化的同時,常常伴有能量的變化,這種能量的變化常以熱能的形式表現(xiàn)出來,叫做反應熱.由于反應的情況不同,反應熱可以分為許多種,如燃燒熱和中和熱等.| 化學鍵 | P-P | P-O | O═O | P═O |
| 鍵能KJ/mol | 197 | 360 | 499 | a |
分析 (1)燃燒熱指1mol物質完全燃燒生成穩(wěn)定的氧化物的反應熱,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和熱指稀溶液中酸與堿反應生成1molH2O的反應熱熱量;
(2)計算出乙烷的物質的量,然后計算出1mol乙烷、2mol乙烷完全燃燒放出熱量,然后根據生成的水必須為液體、反應為放熱角度進行判斷;
(3)白磷燃燒的方程式為P4+5O2=P4O10,根據化學鍵的斷裂和形成的數(shù)目進行計算,需斷 6molP-P和5molO=O,形成12molP-O和4molP=O;
(4)在25℃、101kPa下,1g甲醇(CH3OH)燃燒生成CO2和液態(tài)水時放熱22.68kJ,32g甲醇燃燒生成CO2和液態(tài)水時放熱22.68kJ×32=725.76kJ,1mol甲醇質量為32克,所以完全燃燒1mol甲醇生成二氧化碳和液態(tài)水放熱725.76KJ,根據燃燒熱的概念分析即可解答.
解答 解:(1)A.氫氣的物質的量為2mol,反應熱△H1不能表示燃燒熱;
B.碳燃燒的生成物為CO,表示溫度的氧化物CO2,反應熱△H2不能表示燃燒熱;
C.1mol甲烷完全燃燒,生成的水是氣態(tài),不是穩(wěn)定的狀態(tài),應為液態(tài)水,故反應熱△H3不能表示燃燒熱;
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃燒生成二氧化碳,符合燃燒熱概念,反應熱△H4能表示燃燒熱;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃燒生成二氧化碳與液態(tài)水,符合燃燒熱概念,反應熱△H5能表示燃燒熱;
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中實質是1mol氫離子與1mol氫氧根離子反應生成1molH2O,符合中和熱概念,反應熱△H6能表示中和熱;
G.反應生成的水為2mol,反應熱△H7不能表示中和熱;
故答案為:△H4、△H5;△H6;
(2)15g乙烷的物質的量為:$\frac{15g}{30g/mol}$=0.5mol,0.5mol燃燒放出aakJ的熱量,則1mol乙烷燃燒放出2aKJ熱量,2mol乙烷燃燒放出4aKJ熱量,生成水為液體水,且△<0,正確的熱化學方程式為:2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=-4akJ/mol,只有C符合,
故答案為:C;
(3)白磷燃燒的方程式為P4+5O2=P4O10,1mol白磷完全燃燒需拆開6mol P-P、5mol O=O,形成12molP-O、4mol P=O,
所以12mol×360kJ/mol+4mol×akJ/mol-(6mol×197 kJ/mol+5 mol×499 kJ/mol)=2378.0kJ,a=433.75,
故答案為:433.75;
(4)1g甲醇燃燒生成CO2和液態(tài)水時放熱22.68kJ,則32g即1mol甲醇燃燒放出熱量為725.76kJ/mol,且△H<0,故甲醇的燃燒熱方程為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol,
故答案為:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ/mol.
點評 本題考查燃燒熱與中和熱的概念、反應熱的有關計算、熱化學方程式的意義等,注意中和熱與燃燒熱概念的把握,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3和Na2O2都屬于鹽 | B. | KOH和KHCO3都屬于堿 | ||
| C. | H2SO4和H3PO4都屬于酸 | D. | Na2O和Na2SiO3都屬于氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中一定含Cu2+ | B. | 溶液中不一定含F(xiàn)e2+ | ||
| C. | 剩余固體一定含Cu和Fe | D. | 加入KSCN溶液一定不變紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y的低價氧化物能使Z單質的水溶液褪色 | |
| B. | X的氫化物溶于水顯酸性 | |
| C. | 其離子半徑大小:Z>Y>X | |
| D. | X的氫化物和Z的最高價氧化物對應的水化物不能反應生成鹽 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵粉溶解,沒有任何金屬生成 | B. | 鐵粉未完全溶解 | ||
| C. | 析出0.1mol 銀和0.1mol 銅 | D. | 析出0.1mol 銀和0.05mol 銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 有機玻璃受熱軟化,易于加工成型,是一種硅酸鹽材料 | |
| B. | 煤的氣化是物理變化,是高效、清潔地利用煤的重要途徑 | |
| C. | 純銀器在空氣中久置變黑是因為發(fā)生了電化學腐蝕 | |
| D. | 硫酸亞鐵片和維生素C同時服用,能增強治療缺鐵性貧血的效果 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com