
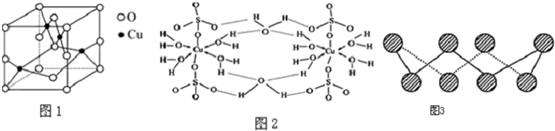
分析 (1)根據Cu的電子排布式書寫Cu2+離子的電子排布式;
(2)利用均攤法分析晶胞的結構;
(3)根據結構示意圖中所有氧原子都是飽和氧原子,存在O→Cu配位鍵,H-O、S-O共價鍵和Cu、O離子鍵,膽礬屬于離子晶體以及膽礬晶體中水兩類,一類是形成配體的水分子,一類是形成氫鍵的水分子等角度分析;
(4)根據電負性的角度分析;
(5)從影響離子晶體熔沸點高低的角度分析;
(6)根據圖片知,每個S原子含有2個σ鍵和2個孤電子對,根據價層電子對互斥理論確定S原子雜化方式;
(7)根據同一主族元素的第一電離能遞變規律判斷.
解答 解:(1)Cu(電子排布式為:[Ar]3d104s1)Cu2+的過程中,參與反應的電子是最外層的4s及3d上各一個電子,故Cu2+離子的電子排布式是為:[Ar]3d9或1s22s22p63s23p63d9,
故答案為:[Ar]3d9或1s22s22p63s23p63d9;
(2)從圖中可以看出陰離子在晶胞有四類:頂點(8個)、棱上(4個)、面上(2個)、體心(1個),根據立方體的分攤法,可知該晶胞中陰離子數目為:8×$\frac{1}{8}$+4×$\frac{1}{4}$+2×$\frac{1}{2}$+1=4,
故答案為:4;
(3)A.氧原子并不都是sp3雜化,該結構中的氧原子部分飽和,部分不飽和,雜化方式不同.從現代物質結構理論出發,硫酸根離子中S和非羥基O之間除了形成1個σ鍵之外,還形成了反饋π鍵.形成π鍵的電子不能處于雜化軌道上,O必須保留未經雜化的p軌道,就不可能是sp3雜化,故A錯誤;
B.在上述結構示意圖中,存在O→Cu配位鍵,H-O、S-O共價鍵和Cu、O離子鍵,故B正確;
C.膽礬是五水硫酸銅,膽礬是由水合銅離子及硫酸根離子構成的,屬于離子晶體,故C錯誤;
D.由于膽礬晶體中水兩類,一類是形成配體的水分子,一類是形成氫鍵的水分子,結合上有著不同,因此受熱時也會因溫度不同而得到不同的產物,故D正確;
故答案為:BD;
(4)N、F、H三種元素的電負性:F>N>H,所以NH3中共用電子對偏向N,而在NF3中,共用電子對偏向F,偏離N原子,所以NF3不易與Cu2+形成配離子,
故答案為:F的電負性比N大,N-F成鍵電子對偏向F,導致NF3中氮原子核對其孤電子對的吸引能力增強,難以形成配位鍵,故NF3不易與Cu2+形成配離子;
(5)由于氧離子的離子半徑小于硫離子的離子半徑,所以亞銅離子與氧離子形成的離子鍵強于亞銅離子與硫離子形成的離子鍵,所以Cu2O的熔點比Cu2S的高.
故答案為:高;Cu2O與Cu2S相比,陽離子相同、陰離子所帶的電荷數也相同,但O2-半徑比S2-半徑小,所以Cu2O的晶格能更大,熔點更高;
(6)根據圖片知,每個S原子含有2個σ鍵和2個孤電子對,所以每個S原子的價層電子對個數是4,則S原子為sp3雜化,
故答案為:sp3;
(7)同主族元素從上到下,原子半徑越來越大,原子核對核外電子的吸引力越來越弱,第一電離能逐漸減小,
故答案為:O>S>Se.
點評 本題考查位置、結構與性質關系的綜合應用,題目難度中等,涉及常見元素核外電子排布、電負性概念、常見軌道雜化類型、以及離子晶體的晶胞結構、化學鍵、物質性質、配合物成鍵狀況等知識,學習中注意加強對晶胞以及晶體結構的分析.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
 ;
;
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用白醋除鐵銹:Fe2O3•xH2O+6H+═(3+x)H2O+2Fe3+ | |
| B. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+N${{H}_{4}}^{+}$+H++S${{O}_{4}}^{2-}$═BaSO4↓+NH3•H2O+H2O | |
| C. | 純堿溶液和苯酚反應:C${{O}_{3}}^{2-}$+2C6H5OH→2C6H5O-+CO2↑+H2O | |
| D. | 用過氧化氫從酸化的海帶灰浸出液中提取碘:2I-+H2O2═I2+2OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 蛋白質在空氣中完全燃燒轉化為水和二氧化碳 | |
| B. | 汽油、甘油、花生油都屬于酯類物質 | |
| C. | 麥芽糖及其水解產物均能發生銀鏡反應 | |
| D. | 燃煤產生的二氧化硫是引起霧霾的主要原因 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | D元素處于元素周期表中第3周期第Ⅳ族 | |
| B. | 四種元素的原子半徑:r(A)<r(B)<r(C)<r(D) | |
| C. | B、D的最高價氧化物中,B、D與氧原子均為雙鍵 | |
| D. | 一定條件下,B單質能轉換出D單質,C產單質能置換出A單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向氯化鋁溶液中滴加過量氨水,生成白色膠狀沉淀:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 加入足量的氫氧化鎂以除去氯化鎂溶液中的少量氯化鐵:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 常溫下0.1mol/L 氯化銨溶液pH=5:NH4++H2O?NH3•H2O+H+ | |
| D. | 電解精煉銅時陽極銅溶解:Cu-2e-═Cu2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
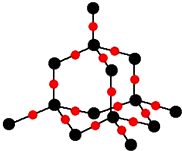 現代世界產量最高的金屬是Fe、Al、Cu.
現代世界產量最高的金屬是Fe、Al、Cu. )分子中碳原子雜化類型為SP2,分子中σ鍵比π鍵多5個.
)分子中碳原子雜化類型為SP2,分子中σ鍵比π鍵多5個.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
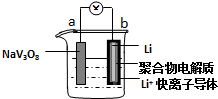
| A. | 放電時,該電池的總反應為:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充電過程中Li+從陽極向陰極遷移 | |
| C. | 充電過程中陽極的電極反應式為NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中釩的化合價發生變化 | |
| D. | 該電池可以用硫酸鈉溶液作電解質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com