
H2S廢氣資源化利用途徑之一是回收能量并得到單質硫。反應原理為:2H2S(g) +O2(g ) ===S2 (s)+2H2O(l) △H=-632kJ·mol-1。右圖為質子膜H2S燃料電池的示意圖。下列說法正確的是
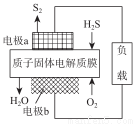
A.電極a為電池的正極
B.電極 b 上發生的電極反應為:O2+4H+ +4e-===2H2O
C.該裝置是一種將熱能轉化為電能的裝置
D.H+經質子膜進入a極區
 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源:2015-2016學年湖北省高二5月月考化學試卷(解析版) 題型:選擇題
近年食品安全倍受關注,下列說法不正確的是( )
A.某白酒中的增塑劑叫鄰苯二甲酸二乙酯( ),對人體健康有害
),對人體健康有害
B.4-甲基咪唑( )是某飲料中檢測出的致癌物,能使酸性高錳酸鉀溶液褪色
)是某飲料中檢測出的致癌物,能使酸性高錳酸鉀溶液褪色
C.某媒體披露“皮革奶”事件,有不法廠商將皮革下腳料水解后摻入奶粉,以提高奶粉中蛋白質的含量。動物皮革的主要成分是蛋白質,“皮革奶”灼燒時有燒焦羽毛的氣味
D.新西蘭牛奶中檢測出有毒的二氰二氨( ),該物質一定不溶于水
),該物質一定不溶于水
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧東北育才學校高二下第二段考化學試卷(解析版) 題型:選擇題
在 分子中,處于同一平面上的碳原子數最多可能有( )
分子中,處于同一平面上的碳原子數最多可能有( )
A.6個 B.8個 C.10個 D.12個
查看答案和解析>>
科目:高中化學 來源:2016屆黑龍江哈爾濱六中高三下三模理綜化學試卷(解析版) 題型:選擇題
NA表示阿伏加德羅常數的值,下列有關說法正確的是
A.12g 金剛石中含有的六元碳環數為NA
B.1L1mol/L 的甲醇水溶液中含有氫原子總數為4NA
C.12g 石墨和 C60的混合物中質子總數為6NA
D.反應 KIO3+6HI=KI+3H2O+3I2中,生成1molI2轉移電子的總數為2NA
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三考前高考模擬十化學試卷(解析版) 題型:填空題
焦炭與CO、CO2、H2均是重要的化工原料,由CO2制備甲醇過程可能涉及的反應如下:
反應Ⅰ:CO2 (g)+3H2 (g)  CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
CH3OH(g)+H2O(g) △H1 =-49.58kJ·mol -1
反應Ⅱ:CO2 (g)+H2 (g)  CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
CO(g)+H2O(g) △H2 =+41.19kJ·mol -1
反應Ⅲ:CO(g)+2H2(g)  CH3OH(g) △H3
CH3OH(g) △H3
回答下列問題:
(1)反應Ⅲ的△H3 = ,反應Ⅲ自發進行的條件是 (填“較低溫”、“較高溫”或“任何溫度”)。
(2)將焦炭與水蒸氣置于容積為2L的密閉容器中發生反應:C(s) +H2O(g)  CO(g)+H2(g),其中H2O、
CO(g)+H2(g),其中H2O、
CO的物質的量隨時間的變化曲線如圖所示。

①0~1min 內用H2表示該反應的速率為 ,第一個平衡時段的平衡常數是 。
②若反應進行到2min時,改變了溫度,使曲線發生如圖所示的變化,則溫度變化為 (填“升溫”或“降溫”)。
③反應至5min時,若也只改變了某—個條件,使曲線發生如圖所示的變化,該條件可能是下述中的 。
a.加入了C(s) b.加入了水蒸氣
c.降低了溫度 d.增大了壓強
(3)某研究小組將一定量的H2和CO2充入恒容密閉容器中并加入合適的催化劑(發生反應Ⅰ、Ⅱ、Ⅲ),測得了不同溫度下體系達到平衡時CO2的轉化率(曲線a)及CH3OH 的產率(曲線b),如圖所示,請回答問題:
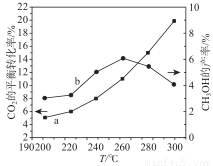
據圖可知當溫度高于260℃后,CO的濃度隨著溫度的升高而 (填“增大”、“減小”、“不變”或“無法判斷”),其原因是 。
(4)若以CO、O2、K2CO3等構成的熔融鹽電池為電源,用惰性電極電解200mL 飽和食鹽水,則負極上的電極反應式為 ,當有2.8g燃料被消耗時,電解池中溶液的pH= (常溫下,忽略溶液的體積變化,不考慮能量的其他損耗)。
查看答案和解析>>
科目:高中化學 來源:2016屆海南中學高三考前高考模擬十化學試卷(解析版) 題型:選擇題
分子式為C9H18O2的有機物A,它能在酸性條件下水解生成B和C,其中C不與NaHCO3溶液反應,1 mol C完全燃燒產生的氣體與足量澄清石灰水反應能生成400g沉淀。則有機物A的可能結構有(不考慮立體異構)
A.4種 B.8種
C.10種 D.16種
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三臨考模擬化學試卷(解析版) 題型:實驗題
現有一份含有FeCl3和FeCl2固體的混合物,為測定FeCl2的含量,進行如下實驗:
①稱取混合物樣品的質量7.06g,將樣品溶解
②向溶解后的溶液中,加入足量的雙氧水
③再向②所得溶液中加入足量的NaOH溶液,得到紅褐色沉淀
④將沉淀過濾、洗滌后,加熱灼燒,到質量不再減少,得到固體物質4.00g
根據實驗回答下列問題:
(1)樣品溶解過程中需加入___________,以防止__________________;
(2)寫出溶解后的溶液與雙氧水反應的離子方程式____________;
(3)過濾操作中除用漏斗外,還需要的玻璃儀器有____________;
(4)簡述檢驗實驗步驟④中沉淀已經洗滌干凈的方法____________;
(5)通過實驗所得數據,計算固體樣品中FeCl2的質量分數:____________;
(6)實驗室采用下列裝置制取少量無水FeCl3固體。(已知FeCl3固體易潮解,部分夾持儀器已略去。)
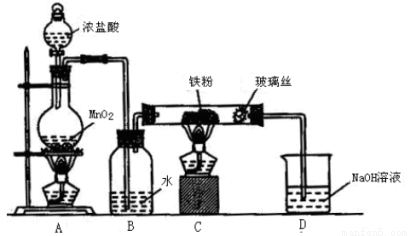
該裝置存在明顯缺陷,得不到無水FeCl3固體,請你對該裝置進行合理的改進:____________。
查看答案和解析>>
科目:高中化學 來源:2016屆海南省高三考前預測化學試卷(解析版) 題型:填空題
某大學實驗室對煤矸石(主要含Al2O3、SiO2及Fe2O3)制備聚合氯化鋁{[Al2(OH)nCl6-n]m(1≤n≤5,m≤10),簡稱PAC,是一種新型、高效的絮凝劑和凈水劑}。其工藝流程如下:
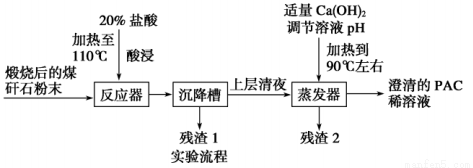
請回答下列問題:
(1)用濃鹽酸配制20%的鹽酸所需的玻璃儀器有______________________________。
(2)加20%的鹽酸酸浸,有關反應的離子方程式為_____________________________。
(3)殘渣2的主要成分是,設計實驗證明你的結論(填操作、現象):_____________________。
(4)由澄清的PAC稀溶液獲得聚合氯化鋁固體,該實驗操作是_________________,得到的PAC粗產品中可能含有的雜質離子是____________。
(5)從不引入雜質的角度來考慮,調節溶液pH的試劑可改為________(填字母)。
A.NaOH B.Al C.氨水 D.Al2O3
查看答案和解析>>
科目:高中化學 來源:2016屆貴州省高三5月高考模擬理綜化學試卷(解析版) 題型:實驗題
工業上用菱錳礦(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等雜質]為原料制取二氧化錳,其流程示意圖如下:
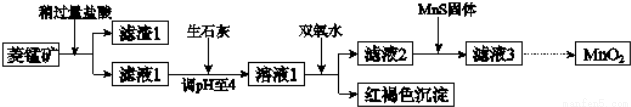
已知:1
生成氫氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀時 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀時 | 9.8 | 8.3 | 3.7 | 6.7 |
2:下表是三種難溶金屬硫化物的溶度積常數(25℃)

回答下列問題:
(1)濾渣1為____________;
(2)向溶液1中加入雙氧水時,反應的離子方程式是____________;
(3)濾液2中加入稍過量的難溶電解質MnS,以除去Cu2+,反應的離子方程式是____________;在CuS、MnS共存的懸濁液中,則c(Cu2+)/c(Mn2+)=____________。
(4)將MnCl2轉化為MnO2的一種方法是氧化法.其具體做法是用酸化的NaClO3溶液將MnCl2氧化,該反應的離子方程式為:5Mn2++2ClO3-+□_____=□_____+□______+□______;
(5)將MnCl2轉化為MnO2的另一種方法是電解法。
①生成MnO2的電極反應式是____________;
②若直接電解MnCl2溶液,生成MnO2的同時會產生少量Cl2,檢驗Cl2的操作是____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com