
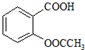
 )是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程如圖1:
)是世界上應用最廣泛的解熱、鎮痛和抗炎藥.乙酰水楊酸受熱易分解,分解溫度為128~135℃.某學習小組在實驗室以水楊酸(鄰羥基苯甲酸)與醋酸酐[(CH3CO)2O]為主要原料合成阿司匹林,制備基本操作流程如圖1: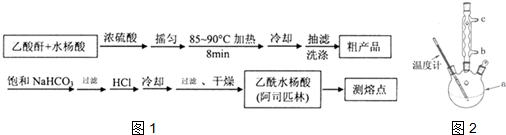
| 名稱 | 相對分子質量 | 熔點或沸點(℃) | 水 |
| 水楊酸 | 138 | 158(熔點) | 微溶 |
| 醋酸 | 102 | 139.4(沸點) | 反應 |
| 乙酸水楊酸 | 180 | 135(熔點) | 微溶 |
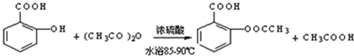 ;
;分析 醋酸酐和水楊酸混合,然后向混合溶液中加入濃硫酸,搖勻后加熱至85℃,然后冷卻、過濾、水洗得到粗產品,然后向粗產品中加入飽和碳酸氫鈉溶液,使乙酰水楊酸轉化為易溶于水的乙酰水楊酸鈉,從而除去雜質;然后加入濃鹽酸除去剩余的碳酸氫鈉、將乙酰水楊酸鈉轉化為乙酰水楊酸,最后過濾、洗滌、干燥得到乙酰水楊酸.
(1)乙酸酐容易水解,
(2)水楊酸與乙酸酐在濃硫酸、水浴85~90℃條件下反應生成 與乙酸;
與乙酸;
(3)①控制溫度85~90℃,應采取水浴加熱;
②向漏斗中加冰水至浸沒沉淀物,使洗滌劑緩慢通過沉淀物,重復上述操作2-3次;
(4)飽和NaHCO3可以使乙酰水楊酸轉化為易溶于水的乙酰水楊酸鈉,便于與聚合物分離;
(5)使用溫度計的目的是控制溫度,防止乙酰水楊酸分解,采取逆流原理通入冷凝水;
(6)水楊酸中含有酚羥基,遇FeCl3溶液發生顯色反應;
(7)先過量計算,根據不足量的物質計算乙酰水楊酸的理論產量,進而計算乙酰水楊酸的產率.
解答 解:醋酸酐和水楊酸混合,然后向混合溶液中加入濃硫酸,搖勻后加熱至85℃,然后冷卻、過濾、水洗得到粗產品,然后向粗產品中加入飽和碳酸氫鈉溶液,使乙酰水楊酸轉化為易溶于水的乙酰水楊酸鈉,從而除去雜質;然后加入濃鹽酸除去剩余的碳酸氫鈉、將乙酰水楊酸鈉轉化為乙酰水楊酸,最后過濾、洗滌、干燥得到乙酰水楊酸.
(1)乙酸酐容易水解,制備阿司匹林時,要使用干燥防止乙酸酐水解
故答案為:防止乙酸酐水解;
(2)水楊酸與乙酸酐在濃硫酸、水浴85~90℃條件下反應生成 與乙酸,反應方程式為:
與乙酸,反應方程式為: ,
,
故答案為: ;
;
(3)①控制溫度85~90℃,溫度低于100℃,應采取水浴加熱,受熱均勻,便于控制溫度,
故答案為:水浴加熱;
②用少量冰水洗滌的具體操作是:關閉水龍頭,向漏斗中加冰水至浸沒沉淀物,使洗滌劑緩慢通過沉淀物,重復上述操作2-3次,
故答案為:關閉水龍頭,向漏斗中加冰水至浸沒沉淀物,使洗滌劑緩慢通過沉淀物,重復上述操作2-3次;
(4)用少量飽和NaHCO3溶解粗產品,目的是使乙酰水楊酸轉化為易溶于水的乙酰水楊酸鈉,便于與聚合物分離,
故答案為:使乙酰水楊酸轉化為易溶于水的乙酰水楊酸鈉,便于與聚合物分離;
(5)使用溫度計的目的是控制溫度,防止乙酰水楊酸分解,采取逆流原理通入冷凝水,充分冷凝,即冷凝水的流進方向是b口,
故答案為:控制反應溫度,防止溫度過高,避免乙酰水楊酸受熱分解;b;
(6)酚羥基能和氯化鐵發生顯色反應,檢驗最終產品中是否含有水楊酸的化學方法是:取少量結晶于試管中,加蒸餾水溶解,滴加FeCl3溶液,若呈紫色則含水楊酸,
故答案為:FeCl3溶液;
(7)水楊酸完全反應消耗乙酸酐質量為2.0g×$\frac{102}{138}$=1.48g<5mL×1.08g/mol=5.4g,故乙酸酐足量,乙酰水楊酸的理論產量為2.0g×$\frac{180}{138}$,乙酰水楊酸的產率為$\frac{2.2g}{2.0×\frac{180}{138}}$×100%=84.3%,
故答案為:84.3%.
點評 本題考查有機物的制備與合成,注意對題目信息的應用,掌握物質分離提純常用方法,較好的考查學生分析能力與知識遷移應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 降低反應體系的壓強 | B. | 增加反應物碳的用量 | ||
| C. | 縮小反應體系的體積 | D. | 減少體系中CO的量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉在空氣中燃燒只生成白色的氧化鈉固體 | |
| B. | 燃著的鎂條伸入盛滿二氧化碳的集氣瓶中不能繼續燃燒 | |
| C. | 銅能與氯化鐵溶液反應,該反應可以用于印刷電路板的制作 | |
| D. | 鐵能與硫酸發生反應,故不能用鐵制容器貯存濃硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
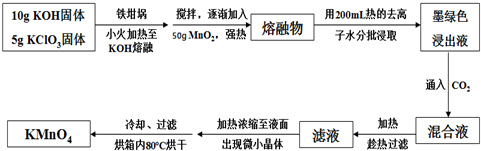
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
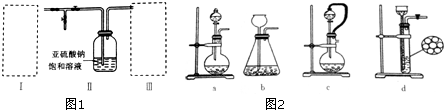
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 以極性鍵結合起來的分子一定是極性分子 | |
| B. | 非極性分子中,一定含有非極性共價鍵 | |
| C. | 乙醇分子和水分子間只存在范德華力 | |
| D. | 鹵素單質按F2→I2,熔沸點逐漸升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
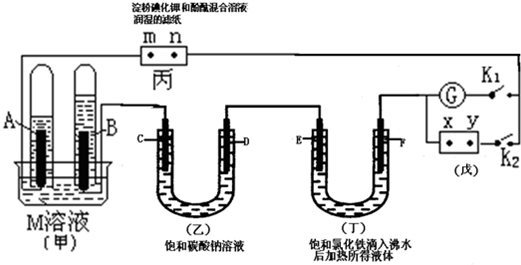
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com