
分析 方法一:在加熱條件下,Cu和濃硫酸反應生成硫酸銅、二氧化硫和水;
方法二:Cu和氧氣在加熱條件下反應生成CuO,CuO和稀硫酸反應生成硫酸銅和水;
工業方法:加熱條件下,Cu和稀硫酸、氧氣反應生成硫酸銅和水,Cu和濃硫酸反應生成大氣污染物且使用的濃硫酸多.
解答 解:方法一:在加熱條件下,Cu和濃硫酸反應生成硫酸銅、二氧化硫和水,反應方程式為Cu+2H2SO4(濃) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
方法二:Cu和氧氣在加熱條件下反應生成CuO,CuO和稀硫酸反應生成硫酸銅和水,反應方程式為:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$22CuO、CuO+H2SO4=CuSO4+H2O;
工業方法:加熱條件下,Cu和稀硫酸、氧氣反應生成硫酸銅和水,反應方程式為2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,根據方程式知,制取相同物質的量的硫酸銅時,濃硫酸使用的多且與濃硫酸反應還生成有毒氣體二氧化硫,污染大氣,所以用Cu、稀硫酸和氧氣制取硫酸銅較好,則用稀硫酸、氧氣和Cu反應制取硫酸銅的優點是:不產生大氣污染物且硫酸用量少,
故答案為:Cu+2H2SO4(濃) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;不產生大氣污染物;硫酸用量少.
點評 本題考查化學實驗方案評價,為高頻考點,側重考查學生比較分析判斷能力,明確元素化合物性質是解本題關鍵,注意制備方案的選擇既應考慮原料的消耗及環境問題,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 第二周期ⅣA族 | B. | 第三周期ⅣA族 | C. | 第四周期ⅣA族 | D. | 第二周期ⅥA族 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的體積/mL | 0.01mol•L-1 Na2SO3 溶液的體積/mL | H2O的體積 /mL | 實驗 溫度 /℃ | 溶液出現藍色時所需時間/s | |
| 實驗1 | 5 | V1 | 35 | 25 | |
| 實驗2 | 5 | 5 | 40 | 25 | |
| 實驗3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙酸乙酯(乙酸):加入乙醇和濃硫酸,然后加熱 | |
| B. | 碳酸鈉固體(碳酸氫鈉):加熱至恒重 | |
| C. | FeCl2溶液(FeCl3、CuCl2):加入過量Fe粉充分攪拌,然后過濾 | |
| D. | 乙醇(水):加入新制的生石灰,然后蒸餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
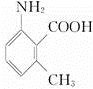 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬的導電性 | B. | 金屬的延展性 | ||
| C. | 地殼中金屬元素的含量 | D. | 金屬冶煉的難易程度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液的酸性逐漸增強 | B. | 碳棒逐漸溶解 | ||
| C. | 溶液中H+向鐵片作定向移動 | D. | 鐵片是負極并被氧化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com