
【題目】最近,著名記者柴靜的霧霾調查紀錄片![]() 穹頂之下
穹頂之下![]() ,在互聯網上產生了爆炸性影響.煤燃燒的尾氣是造成霧霾天氣的原因之一,下列是一種變廢為寶的處理方法.
,在互聯網上產生了爆炸性影響.煤燃燒的尾氣是造成霧霾天氣的原因之一,下列是一種變廢為寶的處理方法.

(1)上述流程中循環使用的物質有 ______ ,吸收池Ⅰ吸收的氣體有 ______ .
(2)向吸收池Ⅳ得到的![]() 溶液中滴加
溶液中滴加![]() 溶液,出現渾濁,pH降低,用平衡移動原理解釋溶液pH降低的原因: ______ .
溶液,出現渾濁,pH降低,用平衡移動原理解釋溶液pH降低的原因: ______ .
(3)電解池Ⅴ制得![]() 的原理如圖1所示.
的原理如圖1所示.
寫出電解總反應的離子方程式 ______ .

(4)![]() 和
和![]() 反應生成
反應生成![]() 和
和![]() ,反應過程中的能量變化如圖2,
,反應過程中的能量變化如圖2,![]() ,
,![]() .
.
已知:①![]()
②![]()
請寫出NO與CO反應生成無污染氣體的熱化學方程式: ______ .
(5)上述流程中每一步均恰好完全反應,若制得![]() 質量為xkg,電解池V制得
質量為xkg,電解池V制得![]() 的
的![]() 溶液
溶液![]() ,則氧化池Ⅵ中消耗的
,則氧化池Ⅵ中消耗的![]() 在標準狀況下的體積為 ______
在標準狀況下的體積為 ______ ![]() .
.
【答案】乙醇胺、![]()
![]() 、
、![]()
![]() 溶液中存在電離平衡:
溶液中存在電離平衡:![]() ,加入氯化鈣以后,鈣離子會消耗硫酸根離子產生硫酸鈣沉淀,導致電離平衡正向移動,氫離子濃度增大,所以溶液pH降低
,加入氯化鈣以后,鈣離子會消耗硫酸根離子產生硫酸鈣沉淀,導致電離平衡正向移動,氫離子濃度增大,所以溶液pH降低 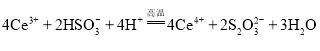
![]() 0.21x-22.4cy
0.21x-22.4cy
【解析】
(1)根據流程圖中物質的循環來判斷循環使用的物質;根據吸收池Ⅰ進入的氣體NO、CO2、SO2結合出來的氣體是NO,來確定吸收的氣體;
(2)亞硫酸氫根離子存在電離平衡,加入氯化鈣,鈣離子會影響化學平衡的移動,根據平衡移動原理來解釋;
(3)根據電解池的工作原理:陽極上是Ce3+失電子的氧化反應,陰極上是HSO3得電子的還原反應,據此書寫電解原理方程式;
(4)已知①![]()
②![]()
298k條件下1mol NO2和1mol CO反應生成1mol CO2和1mol NO的熱化學方程式為③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=(368134)kJ/mol=234kJ/mol,
由蓋斯定律(②①+③)÷2得到反應的熱化學方程式:2NO(g)+2CO(g)N2(g)+2CO2(g),根據蓋斯定律計算焓變;
(5)根據N元素守恒,找到硝酸根離子、亞硝酸根離子以及硝酸銨之間的關系,根據電子守恒,得到Ce3+、Ce4+、S2O32之間的關系,進行計算即可。
(1)根據流程圖中物質的循環,得到循環使用的物質是乙醇胺、Ce4+;根據吸收池Ⅰ進入的氣體NO、CO2、SO2,出來的氣體是NO,確定吸收的氣體是CO2、SO2;故答案為:乙醇胺、Ce4+;CO2、SO2;
(2)HSO3溶液中存在電離平衡:HSO3H++SO32,加入氯化鈣以后,鈣離子會消耗硫酸根離子產生硫酸鈣沉淀,導致電離平衡正向移動,氫離子濃度增大,所以溶液pH降低;故答案為:![]() 溶液中存在電離平衡:
溶液中存在電離平衡:![]() ,加入氯化鈣以后,鈣離子會消耗硫酸根離子產生硫酸鈣沉淀,導致電離平衡正向移動,氫離子濃度增大,所以溶液pH降低;
,加入氯化鈣以后,鈣離子會消耗硫酸根離子產生硫酸鈣沉淀,導致電離平衡正向移動,氫離子濃度增大,所以溶液pH降低;
(3)根據電解池的工作原理:陽極上是Ce3+失電子的氧化反應,陰極上是HSO3得電子的還原反應,電解原理方程式為: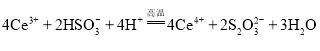 ;故答案為:
;故答案為: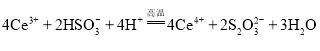 ;
;
(4) 已知①![]()
②![]()
298k條件下1mol NO2和1mol CO反應生成1mol CO2和1mol NO的熱化學方程式為③2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=(
由蓋斯定律(②①+③)÷2得到反應的熱化學方程式:![]() ,故答案為:
,故答案為:![]() ;
;
(5)設亞硝酸根離子、硝酸根離子的物質的量分別是m、n,從Ⅴ→Ⅵ→硝酸銨,根據N元素守恒,得到①m+n=![]() ;
;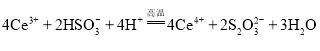 ,結合電子轉移關系,得到4Ce3+~2HSO3~2S2O32~4Ce4+,NO~NO2~e,NO~NO3~e,根據電子守恒,得到m+3n=n(Ce4+)=4n(S2O32),可以得到②m+3n=4cy×1000,聯立①②解得m=
,結合電子轉移關系,得到4Ce3+~2HSO3~2S2O32~4Ce4+,NO~NO2~e,NO~NO3~e,根據電子守恒,得到m+3n=n(Ce4+)=4n(S2O32),可以得到②m+3n=4cy×1000,聯立①②解得m=![]() 2000cy,根據反應2NH3+2H++O2+2NO2=2NH4NO3,得到n(O2)=
2000cy,根據反應2NH3+2H++O2+2NO2=2NH4NO3,得到n(O2)=![]() n(NO2)=(
n(NO2)=(![]() 1000cy)mol,氧氣的體積V=22.4(
1000cy)mol,氧氣的體積V=22.4(![]() 1000cy)×103m3=(0.21x22.4cy)m3,故答案為:0.21x22.4cy。
1000cy)×103m3=(0.21x22.4cy)m3,故答案為:0.21x22.4cy。


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】(1)現有反應CO(g)+2H2(g)CH3OH(g)過程中能量變化如圖所示,寫出該反應的熱化學方程式_____________________________;

(2)已知該反應中相關的化學鍵鍵能數據如圖所示,則C≡O中的鍵能為_____kJmol﹣1;圖中曲線Ⅱ表示____________(填反應條件)的能量變化。
化學鍵 | H﹣H | C﹣O | H﹣O | C﹣H |
E/(kJmol﹣1) | 436 | 343 | 465 | 413 |
(3)圖中數字“419”表示的是_________________________;
(4)下列反應中,屬于放熱反應的是_______ (填編號,下同),屬于吸熱反應的是_______;
①物質燃燒;②炸藥爆炸;③酸堿中和反應;④二氧化碳通過熾熱的碳;⑤食物因氧化而腐敗;⑥Ba(OH)28H2O與NH4Cl反應;⑦鐵粉與稀鹽酸反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝基苯可在金屬錫、鹽酸作用下生成氯化苯銨鹽(![]() )、氯化亞錫(SnCl2)和水。
)、氯化亞錫(SnCl2)和水。
(1)寫出Sn2+的最外層電子排布式___________;Cl-中有_________個填充電子的能級。
(2)畫出硝基的電子式____________,氯化亞錫分子的空間構型是________________;氯化苯胺鹽(![]() )中N原子的雜化方式為_______________,該鹽的水溶度較苯胺大的原因是____________________________________________________。
)中N原子的雜化方式為_______________,該鹽的水溶度較苯胺大的原因是____________________________________________________。
(3)Sn的一種同素異形體——灰錫的晶體結構類似金剛石,立方晶胞結構如圖所示,則錫的配位數是_______。

(4)假設錫原子(如圖中A、B兩原子)在體對角線上外切,晶胞參數為a,計算灰錫的空間利用率約為________________。(百分數表示,取兩位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25 ℃時,CaSO4在水中的沉淀溶解平衡曲線如圖所示,向100 mL該條件下的CaSO4飽和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列敘述正確的是
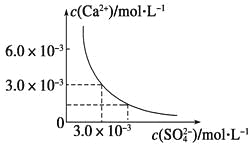
A.溶液中析出CaSO4固體沉淀,最終溶液中c(SO42-)比原來的大
B.溶液中無沉淀析出,溶液中c(Ca2+)、c(SO42-)都變小
C.溶液中析出CaSO4固體沉淀,溶液中c(Ca2+)、c(SO42-)都變小
D.溶液中無沉淀析出,但最終溶液中c(SO42-)比原來的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素R、X、Y、Z的原子序數依次遞增,R的無氧酸溶液能在玻璃容器上刻標記;R和X能形成XR3型化合物,X在化合物中只顯一種化合價;R和Z位于同主族,Y原子最外層電子數等于電子層數的2倍。下列有關推斷正確的是
A. R單質和Z單質均可與水發生反應置換出O2
B. 上述元素形成的簡單離子都能促進水的電離平衡
C. YR6能在氧氣中劇烈燃燒
D. 元素對應的簡單離子的半徑:Y>Z>R>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氮是造成水體富營養化的重要因素之一,用次氯酸鈉水解生成的次氯酸將水中的氨氮(用NH3表示)轉化為氮氣除去,相關反應如下:
①NH3+HClO=NH2Cl+H2O
②NH2Cl+HClO=NHCl2+H2O
③2NHCl2+H2O=N2+HClO+3HCl
已知在水溶液中NH2Cl較穩定,NHCl2不穩定易轉化為氮氣。在其他條件一定的情況下,改變![]() (即NaClO溶液的投入量),溶液中次氯酸鈉去除氨氮效果與余氯(溶液中+1價氯元素的含量)影響如圖所示。則下列說法正確的是( )
(即NaClO溶液的投入量),溶液中次氯酸鈉去除氨氮效果與余氯(溶液中+1價氯元素的含量)影響如圖所示。則下列說法正確的是( )
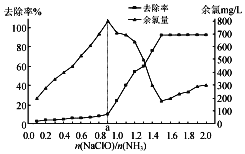
A.次氯酸與氨的總反應可表示為:2NH3+HClO=N2+3H2O+3HCl
B.反應中氨氮去除效果最佳的![]() 值約為1.5
值約為1.5
C.a點之前溶液中發生的主要反應為:NH2Cl+HClO=NHCl2+H2O
D.次氯酸鈉溶液pH較小時有O2生成,促使氨氮去除率提高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯原子對O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大氣臭氧層的分解反應是③O3+O===2O2 ΔH,該反應的能量變化示意圖如圖所示,下列敘述中,正確的是( )

A.反應O3+O===2O2的ΔH=E1-E3B.反應O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸熱反應D.ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酰基扁桃酰氯是一種醫藥中間體。 某研究小組以甲苯和乙醇為主要原料,按下列路線合成乙酰基扁桃酰氯。

已知:

(1)甲苯與氯氣反應生成 A的條件是________。
(2)物質 B中含有的官能團是________。
(3)物質 D 的結構簡式是_________。
(4)下列說法正確的是________。
a.化合物 A不能發生取代反應
b.乙酰基扁桃酰氯屬于芳香烴
c.化合物 C 能與新制的 Cu(OH)2發生反應
(5)E+F→G 的化學方程式是_______。
(6)化合物 D 有多種同分異構體,同時符合下列條件的同分異構體共有_______ 種,寫出其中兩種的同分異構體的結構簡式_______。
①紅外光譜檢測表明分子中含有氰基(-CN);
②1H-NMR 譜檢測表明分子中有苯環,且苯環上有兩種不同化學環境的氫原子。
(7)設計以乙醇為原料制備 F 的合成路線(用流程圖表示;無機試劑任選) _______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二次硝酸(H2N2O2)是一種二元酸,可用于制N2O氣體。
(1)常溫下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,測得溶液pH與NaOH溶液體積的關系如圖所示。
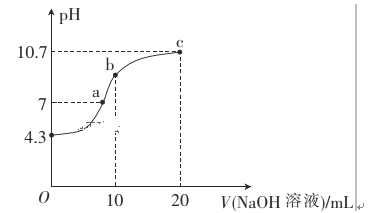
①寫出H2N2O2在水溶液中的電離方程式:______________。
②b點時溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
③a點時溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸銀溶液和連二次硝酸鈉溶液混合,可以得到黃色的連二次硝酸銀沉淀,向該分散系中滴加硫酸鈉溶液,當白色沉淀和黃色沉淀共存時,分散系中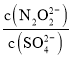 =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com