
【題目】2018年5月9日科技網報道,最新一期國際學術期刊《自然·納米技術》介紹了我國科學家曾杰團隊的成果:在含鉑高效催化劑作用下把二氧化碳高效轉化清潔液態燃料——甲醇。
(1)甲醇燃燒時發生如下反應(a、b、c、d均大于0):
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1
③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1
④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1
由此知,a、b、c、d由小到大排序為_______。
(2)工業上,通常采用氫氣還原CO2法制備甲醇CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(1) △H
CH3OH(g)+H2O(1) △H
已知幾種化學鍵的鍵能數據如下:
共價鍵 | C=O | H-H | C-O | C-H | H-O |
鍵能/kJ·mol-1 | 803 | 436 | 326 | 414 | 464 |
根據鍵能數據估算上述反應中△H=____________kJ·mol-1。
(3)在2L恒容密閉容器中充入2 mol CO2和6.5mlH2,在一定溫度下反應,測得混合氣體中c(CH3OH)與時間的關系如圖1所示。

①M點CO2的正反應速率___________N點CO2的逆反應速率(選填“大于”“小于”或“等于”)。
②0~10min內H2的平均反應速率v(H2)=___________mol·L-1·min-1。
③在該溫度下,該反應平衡常數K為________。(結果保留兩位小數并要求帶單位)
(4)在密閉容器中充入一定量CO2和H2,在含鉑催化劑作用下反應,測得單位時間內CO2的轉化率與溫度關系如圖2所示。
①R點對應的CO2轉化率最大,其原因是_________________。
②在Q點時CO2的轉化率突變的原因可能是_________________。
(5)以石墨為電極,甲醇/空氣堿性(KOH溶液為電解質溶液)燃料電池的能量轉化效率高。當KOH恰好完全轉化成KHCO3時停止放電,此時負極的電極反應式為_____________。
【答案】 d、c、a、b(或d<c<a<b ) -46 大于 0.225 2.25 (Lmin-1)2 R點之前未達到平衡,溫度升高,反應速率加快,單位時間內轉化率增大;R點為平衡點,該反應正反應是放熱反應,R點之后,升溫平衡向左移動,轉化降低 Q點對應的溫度使催化劑失去活性(或該溫度下催化劑的選擇性降低) CH3OH-6e-+7OH-=HCO3-+5H2O
【解析】(1)根據產物、狀態、化學計量數判斷,液態變氣態時要吸收熱量,放出熱量分析判斷;
(2)根據反應熱等于斷裂化學鍵的總鍵能與形成化學鍵的總鍵能之差計算;
(3)①根據M點未達到平衡,向正方向進行;N點達到平衡,正、逆反應速率相等分析判斷;②根據υ(H2)=![]() 計算;③利用三段式計算出平衡時四種物質的濃度,再根據K=
計算;③利用三段式計算出平衡時四種物質的濃度,再根據K=![]() 計算;
計算;
(4)①分析R點轉化率最大,可以從兩個角度一是平衡前,溫度對反應速率的影響,單位時間內轉化率,其實與速率相關。二是平衡后,升溫,平衡移動;②從催化劑活性角度解釋Q點轉化率突變;
(5)負極上甲醇發生氧化反應,氧化產物為KHCO3,據此書寫負極的電極反應式。
(1)①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) △H1=-akJ·mol-1;②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(1) △H2=-bkJ·mol-1;③CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) △H3=-ckJ·mol-1;④CH3OH(1)+O22(g)=CO (g)+2H2O(1) △H4=-dkJ·mol-1;根據產物、狀態、化學計量數判斷,液態變氣態時要吸收熱量,放出熱量:②>①>③>④,故d<c<a<b,故答案為:d<c<a<b;
(2)反應熱等于斷裂化學鍵的總鍵能與形成化學鍵的總鍵能之差。ΔH=(803×2+436×3-326-414×3-464-464×2)kJ·mol-1=-46 kJ·mol-1,故答案為:-46;
(3)①M點未達到平衡,向正方向進行,正反應速率減小;N點達到平衡,正、逆反應速率相等,所以,M點正反應速率大于N點逆反應速率,故答案為:大于;
②υ(H2)=![]() mol·L-1min-1=0.225 mol·L-1min-1,故答案為:0.225;
mol·L-1min-1=0.225 mol·L-1min-1,故答案為:0.225;
③ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始濃度(mol/L) 1 3.25 0 0
轉化濃度(mol/L) 0.75 2.25 0.75 0.75
平衡濃度(mol/L) 0.25 1.00 0.75 0.75
K=![]() =
=![]() (Lmin-1)2=2.25 (Lmin-1)2,故答案為:2.25 (Lmin1)2;
(Lmin-1)2=2.25 (Lmin-1)2,故答案為:2.25 (Lmin1)2;
(4)①單位時間內反應物轉化率與速率有關。分析R點轉化率最大,從兩個角度考慮:一是平衡前,溫度對反應速率的影響,單位時間內轉化率,其實與速率相關。二是平衡后,升溫,平衡移動。即R點之前未達到平衡,溫度升高,反應速率加快,單位時間內轉化率增大;R點為平衡點,該反應正反應是放熱反應,升溫平衡向左移動,轉化降低,故答案為:R點之前未達到平衡,溫度升高,反應速率加快,單位時間內轉化率增大;R點為平衡點,該反應正反應是放熱反應,R點之后,升溫平衡向左移動,轉化降低;
②從催化劑活性角度解釋Q點轉化率突變。即Q點對應的溫度使催化劑失去活性(或該溫度下催化劑的選擇性降低),故答案為:Q點對應的溫度使催化劑失去活性(或該溫度下催化劑的選擇性降低);
(5)負極上甲醇發生氧化反應,氧化產物為KHCO3。故負極的電極反應式為CH3OH-6e+7OH=HCO3+5H2O,故答案為:CH3OH-6e+7OH=HCO3+5H2O。


科目:高中化學 來源: 題型:
【題目】下述實驗中均有紅棕色氣體產生,對比分析所得結論錯誤的是
|
|
|
① | ② | ③ |
A. 由①中的紅棕色氣體,推斷產生的氣體一定是混合氣體
B. ②中紅棕色氣體不能表明木炭與濃硝酸發生了反應
C. 由③說明濃硝酸具有揮發性,生成的紅棕色氣體為還原產物
D. ③的氣體產物中檢測出CO2,由此說明木炭一定與濃硝酸發生了反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子在常溫下一定能大量共存的是( )
A. Na2S溶液中:SO![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
B. 在c(H+)/c(OH-)=1012的溶液中:NH![]() 、NO
、NO![]() 、K+、Cl-
、K+、Cl-
C. 加入鋁粉能放出H2的溶液中:Mg2+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的分類正確的是
A.混合物:空氣、有色玻璃、水銀
B.堿:Ba(OH)2、Cu2(OH)2CO3、NH3·H2O
C.鹽:醋酸鈉、氯化銨、純堿
D.氧化物:H2O、CO、HCOOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】據科技日報網報道,南開大學科研團隊借助鎳和苯基硼酸共催化劑,首次實現烯丙醇高效、綠色合成。烯丙醇及其化合物可成甘油、醫藥、農藥香料,合成維生素E和KI及天然抗癌藥物紫杉醇中都含有關鍵的烯丙醇結構。丙烯醇的結構簡式為CH2=CH-CH2OH。請回答下列問題:
(1)基態鎳原子的價電子排布式為___________________。
(2)1 mol CH2=CH-CH2OH含__________molσ鍵,烯丙醇分子中碳原子的雜化類型為_____________。
(3)丙醛(CHCH2CHO)的沸點為49℃,丙烯醇(CH2=CHCH2OH)的沸點為91℃,二者相對分子質量相等,沸點相差較大的主要原因是_______________________________。
(4)羰基鎳[Ni(CO)4)用于制備高純度鎳粉,它的熔點為-25℃,沸點為43℃。羰基鎳晶體類型是_________________。
(5)Ni2+能形成多種配離子,如[Ni(NH3)6]2+、[Ni(CN)2]2-和[Ni(SCN)2]-等。NH3的空間構型是_____________,與SCN-互為等電子體的分子為____________。
(6)“NiO”晶胞如圖所示。

①氧化鎳晶胞中原子坐標參數:A(0,0,0)、B(1,1,0),則C原子坐標參數為____________。
②已知:氧化鎳晶胞密度為dg·cm-3,NA代表阿伏加德羅常數的值,則Ni2+半徑為__________nm(用代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁廣泛應用于電子陶瓷等工業領域。在一定條件下,AlN可通過以下反應合成:Al2O3+N2+3C![]() 2AlN+3CO。有關該反應下列敘述正確的是
2AlN+3CO。有關該反應下列敘述正確的是
A. 上述反應中,N2是還原劑,Al2O3是氧化劑
B. 上述反應中,每生成1 mol AlN需轉移3 mol電子
C. AlN中氮的化合價為+3
D. AlN的摩爾質量為41 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在0.5molH2S中,約含有________________個氫原子,共有_________mol原子,其質量為____________克,在標況下體積為_____________L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知HA為一元酸,常溫下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,測得溶液pH與所加NaOH溶液體積關系如圖所示。下列說法不正確的是
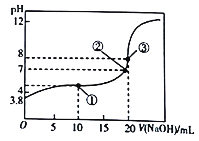
A. 常溫下,該酸的電離常數K=10-5.6
B. 該測定過程中不可以選擇甲基橙為指示劑
C. 滴定至①處時,溶液中離子濃度關系為:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③過程中,水的電離程度先增大后減小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com