
【題目】某強酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一種或幾種離子,取該溶液進行實驗,其現象及轉化如下圖所示。

請回答下列問題:
(1)由整體的實驗過程可判斷溶液X中一定不存在的陰離子有______。
(2)產生氣體A的離子方程式為____________。
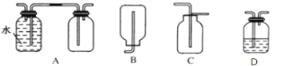
(3)在實驗室中收集氣體A,可選擇如圖裝置中的______。
(4)寫出④反應中生成溶液H的離子方程式____________。
(5)對不能確定是否存在的離子,請簡述檢測實驗方案__________。
【答案】CO32-、SiO32-、NO3- 3Fe2++4H+ +NO3-=3Fe3++NO↑+2H2O A Al3++ 4OH-=AlO2- + 2H2O 用潔凈鉑絲蘸取試樣在火焰上灼燒,觀察火焰顏色,若為黃色,則說明有Na+;若無黃色,則無Na+。
【解析】
(1)溶液X呈強酸性,由于H+與CO32﹣、SiO32﹣會發生反應,不能大量共存,所以不含CO32-、SiO32-;溶液與Ba(NO3)2混合生成沉淀C,則說明溶液中含SO42-,則溶液中不含與SO42-反應形成沉淀的Ba2+,沉淀C是BaSO4;加入Ba(NO3)2溶液產生氣體A,說明含有還原性離子Fe2+;在酸性條件下NO3-具有強氧化性,所以溶液中Fe2+與NO3-不能共存,溶液中不含NO3-;氣體A是NO,NO與O2反應產生的氣體D是NO2;NO2、O2、水反應產生的溶液E是硝酸;溶液B加入過量NaOH溶液產生氣體F,F是NH3,則溶液中含NH4+;硝酸與氨氣反應產生硝酸銨,所以I是NH4NO3;由于溶液B中含有Fe2+氧化產生的Fe3+,所以產生的沉淀G是Fe(OH)3,Fe(OH)3與鹽酸反應產生的J是FeCl3;溶液H中通入過量二氧化碳氣體,產生沉淀,則溶液中含有Al3+,沉淀K是Al(OH)3,溶液L是NaHCO3。
(1)由整體的實驗過程可判斷溶液X中一定不存在的陰離子有CO32-、SiO32-、NO3-;
(2)在酸性條件下,Fe2+、NO3-、H+發生氧化還原反應,產生Fe3+,NO3-被還原產生NO,同時有水生成,反應的離子方程式為3Fe2++4H+ +NO3- =3Fe3++NO↑+2H2O;
(3)氣體A是NO,該氣體容易與空氣中的氧氣反應生成NO2,所以不能用排空氣方法收集,只能用排水方法收集,合理選項是A;
(4)④中Al3+與過量OH-反應生成AlO2-和水,離子方程式為:Al3++ 4OH- =AlO2-+2H2O;
(5)通過前面分析可知:在原溶液中一定含有Al3+、Fe2+、NH4+、SO42-;一定不含有Ba2+、CO32-、SiO32-、NO3-;不能確定的離子是Na+;對于Na+,檢測它的實驗方案是用潔凈鉑絲蘸取試樣在火焰上灼燒,觀察火焰顏色,若為黃色,則說明有Na+;若無黃色,則無Na+。


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】已知Fe3O4是一種復雜的化合物,其化學式可改寫為FeO·Fe2O3。對于A中生成的黑色物質,有三個學習小組提出了三種不同的猜想,以下是小組同學進行的實驗猜想與探究,請你根據小組的思路與提示完成相關空白。
(猜想)甲組:黑色物質是FeO
乙組:黑色物質是Fe3O4
丙組:_____________;
(實驗探究)
(1)丙組認為一種簡單定性的方法即可判斷甲組的正誤:取A中生成的黑色物質少許于燒杯,加稀鹽酸使其完全溶解,再加______溶液以檢驗Fe3+,觀察到溶液有無出現_________現象即可判斷。
(2)乙組認為可通過定量測定來確定A中生成的黑色物質的組成,以驗證該組猜想正確。取A中生成的黑色物質2.32g溶解于適量稀鹽酸后,加入新制氯水,加入氯水后反應的離子方程式為:_____________,再加入足量NaOH溶液后,過濾洗滌烘干灼燒稱量,若稱得固體質量為________,即可判斷乙組同學猜想正確。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應KClO3 + 6HCl= 3Cl2↑+KCl + 3H2O,下列有關的說法中,正確的是( )
A. HCl 中的Cl 全部被氧化 B. 失電子的氯原子是得電子的氯原子的5倍
C. 反應中有6mol電子發生轉移 D. 反應中KClO3 被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組制取氯酸鉀和氯水并進行有關探究實驗。
實驗一 制取氯酸鉀和氯水
利用下圖所示的實驗裝置進行實驗。
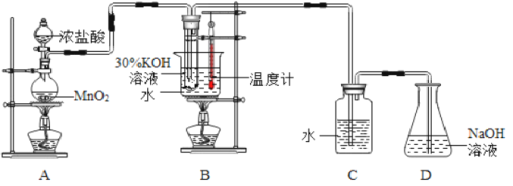
(1)制取實驗結束后,取出B中試管冷卻結晶,過濾,洗滌。過濾操作過程中需要的玻璃儀器有__________。
(2)若對調B和C裝置的位置,_____(填“能”或“不能”)提高B中氯酸鉀的產率。D裝置的作用是___________________。
(3)在實驗過程中,若要檢驗C裝置的瓶塞處是否密封好,請簡述化學檢驗方案_______。
實驗二 氯酸鉀與碘化鉀反應的研究
(4)在不同條件下KClO3可將KI氧化為I2或KIO3.該小組設計了系列實驗研究反應條件對反應產物的影響,其中系列a實驗的記錄如下(實驗在室溫下進行):
試管編號 | 1 | 2 | 3 | 4 |
0.2molL﹣1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL﹣1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸餾水/mL | 9.0 | 6.0 | 3.0 | 0 |
實驗現象 |
①系列a實驗的實驗目的是___________________________。
②設計1號試管實驗的作用是__________________________。
③若2號試管實驗現象為"黃色溶液",取少量該溶液加入淀粉溶液顯藍色;假設氧化產物唯一,還原產物為KCl,則此反應的離子方程式為__________________________。
p>實驗三 測定飽和氯水中氯元素的總量(5)根據下列資料,為該小組設計一個可行的實驗方案(不必描述操作過程的細節):____。
資料:i.次氯酸會破壞酸堿指示劑;
ii.次氯酸或氯氣可被SO2、H2O2和FeCl2等物質還原成Cl﹣。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太陽能分解10mol水消耗的能量是____________kJ;
(2)由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應:
甲醇合成反應:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤氣變換反應:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反應:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
則由H2和CO直接制備二甲醚(另一產物為水蒸氣)的熱化學方程式為____________。
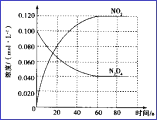
(3)在容積為1.00L的容器中,通入一定量N2O4,發生N2O4(g) ![]() 2NO2(g), 100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,v(N2O4)=_______________________,
2NO2(g), 100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,v(N2O4)=_______________________,
(4)已知反應2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________kJ。在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反應中,正反應速率為v正= k正·x2(HI),逆反應速率為v逆=k逆·x(H2)·x(I2),其中k正、k逆為速率常數, 若k正 = 0.0027min-1,在t=40min時,v正=_______min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常利用以下反應制取少量氮氣:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;關于該反應的下列說法不正確的是( )
NaCl+N2↑+2H2O;關于該反應的下列說法不正確的是( )
A. Na2NO2是氧化劑,NH4Cl是原劑
B. N2既是氧化產物,又是還原產物
C. NH4Cl中氮元素被還原
D. 每生成1molN2轉移電子的物質的量為3mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國重離子研究中心2010年2月19日宣布,由該中心人工合成的第ll2號化學元素從即日起獲正式名稱“Copemicium”,相應的元素符號為“Cn”。該元素的名稱是為了紀念著名天文學家哥白尼而得名。該中心人工合成Cn的過程可表示為:7030Zn+20882Pb→277112Cn+10n。下列敘述中正確的是 ( )
A. 上述合成過程屬于化學變化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相對原子質量為277
D. 277112Cn的原子核內質子數比中子數多53
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com