
【題目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃燒熱△H分別為-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。那么用太陽能分解10mol水消耗的能量是____________kJ;
(2)由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應:
甲醇合成反應:
(i)CO(g) + 2H2(g) = CH3OH(g) △H1 = -90.1kJmol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJmol-1
水煤氣變換反應:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJmol-1
二甲醚合成反應:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJmol-1
則由H2和CO直接制備二甲醚(另一產物為水蒸氣)的熱化學方程式為____________。
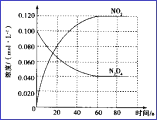
(3)在容積為1.00L的容器中,通入一定量N2O4,發生N2O4(g) ![]() 2NO2(g), 100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,v(N2O4)=_______________________,
2NO2(g), 100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,v(N2O4)=_______________________,
(4)已知反應2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為___________kJ。在716K時,氣體混合物中碘化氫的物質的量分數x(HI)與反應時間t的關系如下表
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
上述反應中,正反應速率為v正= k正·x2(HI),逆反應速率為v逆=k逆·x(H2)·x(I2),其中k正、k逆為速率常數, 若k正 = 0.0027min-1,在t=40min時,v正=_______min-1
【答案】 2858 2CO(g)+4H2(g)=CH3OCH3(g) +H2O(g) △=-204.7 kJmol-1 0.0010mol/(L·s) 299 1.95×10-3
【解析】(1)由H2(g)的燃燒熱△H為﹣285.8kJmol﹣1知,1molH2(g)完全燃燒生成1molH2O(l)放出熱量285.8kJ,即分解1mol H2O(l)為1mol H2(g)消耗的能量為285.8kJ,則分解10mol H2O(l)消耗的能量為285.8kJ×10=2858kJ。
(2)(i)CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJmol﹣1;(iV)2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=﹣24.5kJmol﹣1;依據蓋斯定律,由(i)×2+(iV)可以得到由H2和CO直接制備二甲醚的熱化學方程式:2CO(g)+4H2(g)=CH3OCH3+H2O(g) △H=﹣204.7kJmol﹣1。
(3)由圖可知,在0~60s時段,的濃度由0.100 mol/L減小到0.040 mol/L,減小了0.060 mol/L,所以v(N2O4)= ![]() =0.0010mol/(L·s)。
=0.0010mol/(L·s)。
(4)已知反應2HI(g)=H2(g) + I2(g)的ΔH= +11kJ·mol-1,1molH2(g)、1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,ΔH=反應物的鍵能總和-生成物的鍵能總和,則1molHI(g)分子中化學鍵斷裂時需吸收的能量為(+11kJ+436kJ +151kJ)![]() +299kJ。由表中數據可知,在t=40min時,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1
+299kJ。由表中數據可知,在t=40min時,x(HI)= 0.85 ,若k正 = 0.0027min-1,v正= k正·x2(HI)=0.0027min-1![]() 1.95×10-3min-1。
1.95×10-3min-1。


 100分闖關期末沖刺系列答案
100分闖關期末沖刺系列答案科目:高中化學 來源: 題型:
【題目】(1)官能團與有機物的性質密切相關。
①下列物質易溶于水的是_____________________(填字母)。
a.異丁烷 b.乙醇 c.氯乙烯
②下列物質不能發生水解反應的是_____________________(填字母)。
a.葡萄糖 b.溴乙烷 c.乙酸乙酯
③可用酸性KMnO4溶液鑒別的一組物質是_____________________(填字母)。
a.甲烷與乙烷 b.乙烯與乙炔 c.苯和甲苯
(2)對香豆酸的結構簡式如右圖所示。
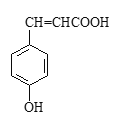
①對香豆酸分子中位于同一平面的碳原子最多有_____________________個。
②1mol對香豆酸最多可與____________________ molH2發生加成反應。
③聚對香豆酸的結構簡式為____________________。
(3)D(胡椒醛)是一種食品香料,以A為原料制備D的一種合成路線如下:
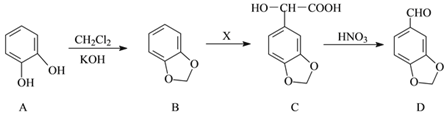
①A→B的反應類型是____________________;C中的含氧官能團名稱為_____________________和____________________(填二種)。
②X的分子式為C2H2O3,B→C為加成反應,X的結構簡式為____________________。
③芳香化合物Y是D的同分異構體,Y既能與NaHCO3反應生成CO2又能發生銀鏡反應,苯環上的一硝基取代物只有二種。符合題意的Y的結構簡式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質中,X是主要物質,Y是少量雜質,Z是為除去雜質所要加入的試劑,其中所加試劑正確的組合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某強酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Na+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一種或幾種離子,取該溶液進行實驗,其現象及轉化如下圖所示。

請回答下列問題:
(1)由整體的實驗過程可判斷溶液X中一定不存在的陰離子有______。
(2)產生氣體A的離子方程式為____________。
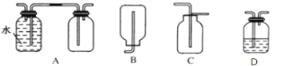
(3)在實驗室中收集氣體A,可選擇如圖裝置中的______。
(4)寫出④反應中生成溶液H的離子方程式____________。
(5)對不能確定是否存在的離子,請簡述檢測實驗方案__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為驗證氧化性Cl2>Fe3+>SO2,某小組用如圖所示裝置進行實驗(夾持儀器和A中加熱裝置已略,氣密性已檢驗)。
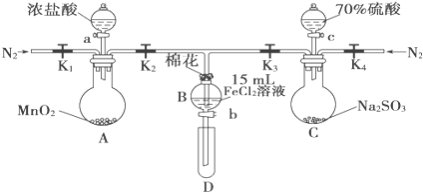
實驗過程:
Ⅰ.打開彈簧夾K1~K4,通入一段時間N2,再將T型導管插入B中,繼續通入N2,然后關閉K1、K3、K4。
Ⅱ.打開活塞a,滴加一定量的濃鹽酸,給A加熱。
Ⅲ.當B中溶液變黃時,停止加熱,關閉K2。
Ⅳ.打開活塞b,使約2mL的溶液流入D試管中,檢驗其中的離子。
Ⅴ.打開K3和活塞c,加入70%的硫酸,一段時間后關閉K。
Ⅵ.更新試管D,重復過程Ⅳ,檢驗B溶液中的離子。
(1)過程Ⅰ的目的是__________________________。
(2)實驗室在保存FeCl2溶液時為了防止FeCl2溶液變質,經常向其中加入鐵粉,其原因是__________________________。
(3)若向第III步B中的黃色溶液中通入H2S氣體,會觀察到有淡黃色沉淀生成,寫出該反應的化學方程式__________________________。
(4)若將制取的SO2通入硫酸酸化的高錳酸鉀溶液可使溶液褪色,其反應的離子方程式為__________________________。
(5)甲、乙、丙三位同學分別完成了上述實驗,結論如下表所示.他們的檢測結果一定能夠證明氧化性Cl2>Fe3+>SO2的是_____(填“甲”、“乙”或“丙”)。
過程Ⅳ,B溶液中含有的離子 | 過程Ⅵ,B溶液中含有的離子 | |
甲 | 有Fe3+無Fe2+ | 有Fe2+ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+無Fe2+ | 有SO42﹣ |
(6)將B中的FeCl2溶液換成100mLFeBr2溶液并向其中通入2.24LCl2(標準狀況下),若溶液中有1/2的Br﹣被氧化成單質Br2,則原FeBr2溶液中FeBr2的物質的量濃度為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁、氧化鋁、氫氧化鋁和可溶性鋁鹽與過量強堿溶液的反應,其生成物有一定的規律,下列說法中正確的是
A.都有H2O生成 B.都有H2生成
C.都有AlO2-生成 D.都有Al3+生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一未知的無色溶液,只可能含有以下離子中的若干種:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,現取三份100 mL溶液進行如下實驗:
①第一份加入足量AgNO3溶液后,有白色沉淀產生。
②第二份加入足量BaCl2溶液后,有白色沉淀產生,經洗滌、干燥后,沉淀質量為6.99 g。
③第三份逐滴滴加NaOH溶液,測得沉淀與NaOH溶液的體積關系如圖所示。
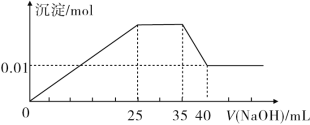
根據上述實驗,完成下列問題:
(1)原溶液中一定不存在的離子是______________。
(2)25~35段發生反應的離子方程式為__________。
(3)35~40段發生反應的離子方程式為__________。
(4)實驗所加的NaOH的濃度為________。
(5)原溶液中NO3-的物質的量為n(NO3-),根據提供的圖像和數據,試計算n(NO3-)的取值范圍為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】全釩液流電池是一種新型的綠色環保儲能電池,工作原理如圖所示,a、b均為惰性電極,放電時左槽溶液顏色由黃色變為藍色。下列敘述正確的是
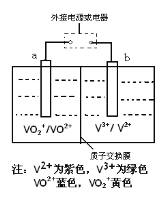
A.充電時右槽溶液顏色由紫色變為綠色
B.放電時,b極發生還原反應
C.充電過程中,a極的反應式為:VO2++2H++e—= VO2+ +H2O
D.電池的總反應可表示為:VO2++V2++2H+ ![]() VO2++V3++H2O
VO2++V3++H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著我國汽車年銷量的大幅增加,給空氣環境造成了很大的污染。汽車尾氣裝置里,氣體在催化劑表面吸附與解吸作用的過程如圖所示,下列說法正確的是( )

A. 反應中NO為氧化劑,N2為氧化產物
B. 汽車尾氣的主要污染成分包括CO、NO和N2
C. NO和O2必須在催化劑表面才能反應
D. 催化轉化總化學方程式為2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com