
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 .
.分析 (1)由元素在周期表中位置,可知A為Na,B為K元素,C為Mg,D為Al,E為C元素,F為O元素,G為Cl,H為Br,R為Ar;稀有氣體化學性質最不活潑;
(2)D元素、A元素的最高價氧化物對應的水化物分別為Al(OH)3、NaOH,二者反應生成偏鋁酸鈉與水;
(3)同周期自左而右原子半徑減小,同主族自上而下原子半徑增大;
(4)F元素的簡單氫化物是水;不同元素原子之間形成的共價鍵為極性鍵;常溫下,鉀與是反應生成KOH與氫氣;
(5)H元素跟A元素形成化合物為溴化鈉,含有鈉元素,高溫灼燒該化合物時,火焰呈黃色,屬于離子化合物,由鈉離子與溴離子構成,用Na原子、Br原子電子式表示其形成過程;
(6)非金屬性越強,氫化物越穩定、最高價含氧酸的酸性越強.
解答 解:(1)由元素在周期表中位置,可知A為Na,B為K元素,C為Mg,D為Al,E為C元素,F為O元素,G為Cl,H為Br,R為Ar;稀有氣體Ar原子最外層為穩定結構,其化學性質最不活潑,
故答案為:Na; K;Mg;Al;C;O;Cl;Br;Ar;Ar;
(2)D元素、A元素的最高價氧化物對應的水化物分別為Al(OH)3、NaOH,二者反應生成偏鋁酸鈉與水,反應離子方程式為:Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O;
(3)同周期自左而右原子半徑減小,同主族自上而下原子半徑增大,故原子半徑:K>Na>Mg,
故答案為:K>Na>Mg;
(4)F元素氫化物是H2O,O原子與H原子之間形成極性鍵,常溫下,鉀與是反應生成KOH與氫氣,反應方程式為:2K+2H2O=2KOH+H2↑,
故答案為:H2O;極性鍵;2K+2H2O=2KOH+H2↑;
(5)H元素跟A元素形成化合物是溴化鈉,化學式為NaBr,含有鈉元素,高溫灼燒該化合物時,火焰呈黃色,屬于離子化合物,由鈉離子與溴離子構成,用Na原子、Br原子電子式表示其形成過程為 ,
,
故答案為:NaBr;黃; ;
;
(6)同主族自上而下,非金屬性減弱,非金屬性越強,氫化物越穩定、最高價含氧酸的酸性越強,故氫化物穩定性HCl>HBr,酸性:HClO4>HBrO4,
故答案為:HCl;HClO4.
點評 本題考查元素周期表與元素周期表綜合應用,比較基礎,注意對元素周期表的整體把握,有利于基礎知識的鞏固.


 小學課時特訓系列答案
小學課時特訓系列答案科目:高中化學 來源: 題型:解答題
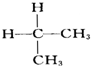 與
與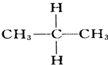
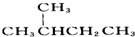 與
與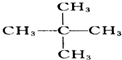
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HX>HZ>HY | B. | HZ>HY>HZ | C. | HX>HY>HZ | D. | HY>HZ>HX |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在鈉、鉀、銣3種單質中,銣的熔點最高 | |
| B. | 硝酸銣是離子化合物 | |
| C. | 它位于周期表的第四周期、第ⅠA族 | |
| D. | 氫氧化銣是弱堿 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酯化反應、硝化反應以及酯的水解均屬于取代反應類型 | |
| B. | 乙醇生成溴乙烷和乙烯生成溴乙烷的反應類型相同 | |
| C. | 可用氫氧化鈉溶液除去乙酸乙酯中混有的乙酸和乙醇 | |
| D. | 甲烷、苯都屬于烴,都不存在同分異構體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com