
| 溫度 n(CO) 時間 | 0 | 10 | 20 | … | 40 | 50 |
| T1 | 1.0 | 0.7 | 0.5 | … | 0.25 | 0.25 |
| T2 | 1.0 | 0.65 | 0.4 | … | 0.28 | 0.28 |
| A. | T1溫度下平衡后恒容再充入0.5molCO,重新平衡后CO總的轉化率與H2相等 | |
| B. | T1溫度下10-20sH2的反應速率為0.04mol•L-1•s-1 | |
| C. | 該反應的△Η>0 | |
| D. | T2溫度下平衡后恒定壓強不變充入0.28molCH3OH,CH3OH的體積分數不變 |
分析 A.平衡后恒容再充入0.5molCO,由pV=nRT可知,n增大,壓強增大,平衡正向移動,若起始量之比等于化學計量數之比時,轉化率相同;
B.結合v=$\frac{△c}{△t}$計算;
C.由表格數據可知,T2的反應速率大,且平衡時CO的含量大;
D.平衡后恒定壓強不變充入0.28molCH3OH,由pV=nRT可知,n增大,V增大,則壓強減小,平衡逆向移動.
解答 解:A.平衡后恒容再充入0.5molCO,由pV=nRT可知,n增大,壓強增大,平衡正向移動,等效為
CO(g)+2H2(g)?CH3OH(g)
開始 0.75 1.5 0
轉化 x 2x x
CO與氫氣的起始量之比等于化學計量數之比,$\frac{x}{0.75}$=$\frac{2x}{1.5}$,則重新平衡后CO總的轉化率與H2相等,故A正確;
B.T1溫度下10-20sCO的反應速率為$\frac{\frac{0.3mol}{2L}}{10s}$=0.015mol•L-1•s-1,由速率之比等于化學計量數之比可知,10-20sH2的反應速率為0.03mol•L-1•s-1,故B錯誤;
C.由表格數據可知,T2的反應速率大,且平衡時CO的含量大,則升高溫度平衡逆向移動,正反應為放熱反應,故C錯誤;
D.平衡后恒定壓強不變充入0.28molCH3OH,由pV=nRT可知,n增大,V增大,則壓強減小,平衡逆向移動,則CH3OH的體積分數減小,故D錯誤;
故選A.
點評 本題考查化學平衡的計算,為高考常見題型和高頻考點,把握轉化率的計算、速率計算、平衡移動為解答的關鍵,側重分析與應用能力的考查,注意表格數據的應用,題目難度不大.


 培優三好生系列答案
培優三好生系列答案科目:高中化學 來源: 題型:選擇題
| A. | 起到殺菌作用 | B. | 使水中次氯酸分解 | ||
| C. | 提高水的溫度 | D. | 增加水中氧氣的含量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14g乙烯和丙烯混合氣體中的氫原子數為2NA | |
| B. | 7.8g Na2S固體和7.8g Na2O2固體中含有的陰離子數目均為0.1NA | |
| C. | 標準狀況下,5.6L二氧化碳氣體中含有的氧原子數目為0.5NA | |
| D. | 0.5mol/LHCl 溶液中含有的氫離子數為0.05NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | W、Y的最高價氧化物都是氣體 | |
| B. | Y、Z形成的化合物一定為共價化合物 | |
| C. | 四種元素中W元素的非金屬性最強 | |
| D. | W、X、Y、Z的原子半徑大小順序一定是:Z>Y>X>W |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 方案 | 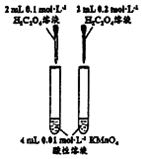 |  | 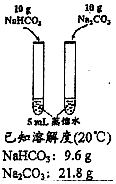 |  |
| 目的 | 探究濃度對化學反應速率的影響 | 制備氨氣 | 室溫下比較NaHCO3和Na2CO3的溶解度 | 探究溫度對化學平衡的影響 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol I2(s)中通入2 g H2(g),反應吸熱26.48 kJ | |
| B. | 1 mol固態碘與1 mol氣態碘所含的能量相差17.00 kJ | |
| C. | 反應(ⅱ)的反應物總能量比反應(ⅰ)的反應物總能量低 | |
| D. | 反應(ⅰ)放出的熱量多,所以產物的能量低,比反應(ⅱ)的產物更穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | lmol Na2O2與足量水反應后產生氧氣,理論上轉移的電子數為2×6.02×1023 | |
| B. | SiO2(s)+2C(s)=Si(s)+2CO(g)在常溫下不能自發進行,則該反應的△H>0 | |
| C. | 稀釋0.1 mol•L-1CH3COOH溶液,溶液中所有離子濃度均減小 | |
| D. | 鉛蓄電池在充電過程中,兩極質量都增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
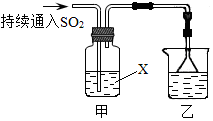
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com