考點:離子共存問題
專題:離子反應專題
分析:①常溫下,
=1×10
-12的溶液為堿性溶液,K
+、AlO
2-、CO
32-、Na
+離子之間不發生反應,也不與氫氧根離子反應;
②加入苯酚顯紫色的溶液中存在大量鐵離子,鐵離子具有氧化性,能夠氧化碘離子;
③使酚酞變紅的溶液為堿性溶液,溶液中存在大量的氫氧根離子,鐵離子、鋁離子能夠與氫氧根離子反應生成沉淀;
④使甲基橙變紅的溶液中存在大量的氫離子,NH
4+、Na
+、SO
42-、Cl
-之間不發生反應,也不與氫離子反應;
⑤無色溶液中.鋁離子與碳酸氫根離子發生雙水解反應生成二氧化碳氣體和氫氧化鋁沉淀.
解答:
解:①常溫下,
=1×10
-12的溶液中存在大量的氫氧根離子,K
+、AlO
2-、CO
32-、Na
+之間不反應,都不與氫氧根離子反應,在溶液中能夠大量共存,故①正確;
②加入苯酚顯紫色的溶液中存在Fe
3+,Fe
3+能夠氧化I
-,在溶液中不能大量共存,故②錯誤;
③使酚酞變紅的溶液為堿性溶液,Fe
3+、Al
3+能夠與堿溶液反應生成難溶物,在溶液中不能大量共存,故③錯誤;
④使甲基橙變紅的溶液中為酸性溶液,NH
4+、Na
+、SO
42-、Cl
-之間不反應,且都不與酸溶液反應,在溶液中能夠大量共存,故④正確;
⑤Al
3+、HCO
3-之間發生雙水解反應生成氫氧化鋁沉淀和二氧化碳氣體,在溶液中不能大量共存,故⑤錯誤;
故選A.
點評:本題考查離子共存的正誤判斷,為高考中的高頻題,屬于中等難度的試題,注意明確離子不能大量共存的一般情況:能發生復分解反應的離子之間;能生成難溶物的離子之間;能發生氧化還原反應的離子之間等; 還應該注意題目所隱含的條件,如:溶液的酸堿性,據此來判斷溶液中是否有大量的 H+或OH-;溶液的顏色,如無色時可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色離子的存在等.



 閱讀快車系列答案
閱讀快車系列答案 奧運會中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中正確的是( )
奧運會中服用興奮劑既有失公平,也敗壞了體育道德.某種興奮劑的結構簡式如圖所示.有關該物質的說法中正確的是( ) 與
與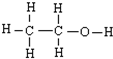 都可以用來描述乙醇的結構
都可以用來描述乙醇的結構 該有機物的系統名稱為:2-甲基-1-丙醇
該有機物的系統名稱為:2-甲基-1-丙醇 +SO2+H2O→
+SO2+H2O→ +Na2SO3,說明給出質子能力:HSO3->苯酚
+Na2SO3,說明給出質子能力:HSO3->苯酚