
分析 Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O中,Cu元素的化合價升高,N元素的化合價降低,該反應轉移2e-,以此來解答.
解答 解:Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O中,N元素的化合價降低,HNO3為氧化劑,Cu元素的化合價升高,Cu為還原劑,由反應可知,2mol硝酸作酸、2mol作氧化劑,則被還原的HNO3與參加反應的HNO3物質的量之比是1:2,當1.28g Cu參加反應時,電子轉移的物質的量是$\frac{1.28g}{64g/mol}$×(2-0)=0.04mol,
故答案為:HNO3;Cu;1:2;0.04mol.
點評 本題考查氧化還原反應及計算,為高頻考點,把握反應中元素的化合價變化為解答的關鍵,側重分析與應用能力的考查,注意利用化合價計算轉移電子,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | ①③⑦ | B. | ②⑤⑥ | C. | ②③⑦ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
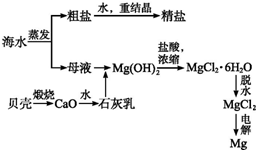 海水的綜合利用可以制備金屬鎂,其流程如圖所示:
海水的綜合利用可以制備金屬鎂,其流程如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
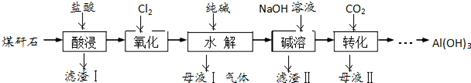
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純堿-Na2CO3 | B. | 熟石灰-Ca(OH)2 | ||
| C. | 明礬-Al2(SO4)3•12H2O | D. | 膽礬-CuSO4•5H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
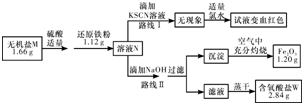
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| B. | 常溫下將醋酸鈉、鹽酸兩溶液混合后,溶液呈中性,則混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常溫下物質的量濃度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三種溶液中水的電離程度:①>③>② | |
| D. | 等體積等物質的量濃度的NaClO(aq)與NaCl(aq)中離子總數:N前>N后 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com