
| A. | 該反應是焓變為負值 | |
| B. | 恒溫恒容下,增大壓強,H2濃度一定減小 | |
| C. | 升高溫度,逆反應速率減小 | |
| D. | 該反應化學方程式為CO2(g)+H2(g) $?_{高溫}^{催化劑}$ CO(g)+H2O(g) |
分析 平衡常數指可逆反應達到平衡時各生成物濃度的化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值,化學平衡常數K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$,所以該反應化學方程式應為CO2+H2?CO+H2O,恒容時,溫度升高,H2 濃度減小,平衡向正反應移動,則該反應為吸熱反應,以此來解答.
解答 解:A、恒容時,溫度升高,H2濃度減小,則該反應為吸熱反應,所以△H>0,故A錯誤;
B、恒溫恒容下,若通入氫氣,增大壓強,則H2濃度增大,故B錯誤;
C、升高溫度,正、逆反應速率都增大,正反應速率增大更多,平衡正向移動,故C錯誤;
D、由平衡常數K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$可知,該反應為CO2(g)+H2(g)$\frac{\underline{\;催化劑\;}}{△}$CO(g)+H2O(g),故D正確;
故選D.
點評 本題考查化學平衡常數、影響化學平衡的因素等,難度中等,注意對化學平衡常數的理解,同一反應化學計量數不同平衡常數不同.


科目:高中化學 來源: 題型:解答題
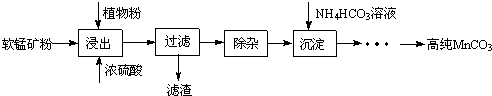
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| A | ①能使溴的四氯化碳溶液褪色;②比例模型為 ;③能與水在一定條件下反應生成C ;③能與水在一定條件下反應生成C |
| B | ①由C、H兩種元素組成;②球棍模型為 |
| C | ①由C、H、O三種元素組成;②能與Na反應,但不能與NaOH溶液反應;③能與E反應生成相對分子質量為100的酯 |
| D | ①相對分子質量比C少2;②能由C氧化而成. |
| E | ①由C、H、O三種元素組成;②球棍模型為 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
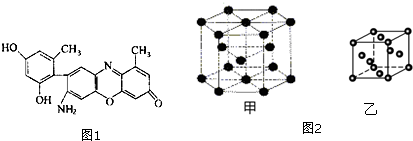
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增加H2的量 | |
| B. | 將容器的體積縮小一半 | |
| C. | 壓強不變,充入氮氣使容器體積增大 | |
| D. | 體積不變,充入氮氣使容器壓強增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 2:5 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com