
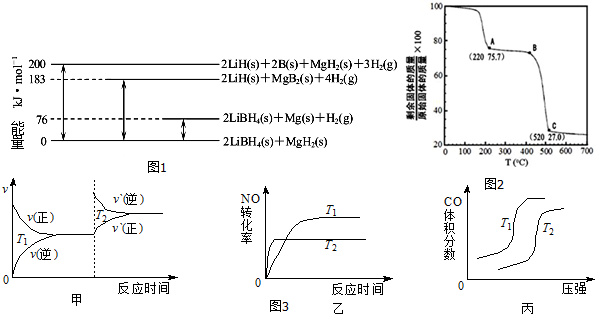
分析 (1)根據反應熱的意義,由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④,
應用蓋斯定律計算化學反應的焓變;
(2)先將MgCl2•6H20轉化為MgCl2•NH4Cl•nNH3,然后在700℃脫氨得到無水氯化鎂,依據原子守恒書寫化學方程式;
(3)根據方程式的意義:Mg(AlH4)2=MgH2+2Al+3H2↑,反應中生成2molAl轉移電子6mol,據此計算即可;
(4)用MgC2O4•2H2O熱分解制超細MgO,當最后固體完全為MgO時,可以計算剩余固體質量占原先固體質量的百分比,得到C點剩余的固體,MgC2O4•2H2O加熱后先失去結晶水,完全失去結晶水后生成MgC2O4時,可以計算剩余固體質量占原先固體質量的百分比,最后根據氧化還原反應特點,寫出反應的化學方程式;
(5)甲、升高溫度,平衡正向移動,正逆反應速率都增大;
乙、升高溫度,平衡正向移動;溫度高的先拐,先達平衡;
丙、增大壓強,平衡正向移動,據此判斷CO的體積分數變化的情況.
解答 解:(1)由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1
故答案為:-93 kJ•mol-1;
(2)MgCl2•NH4Cl•nNH3,在700℃脫氨得到無水氯化鎂,反應的化學方程式:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑↑;用惰性電極電解熔融氯化鎂,陰極上是鎂離子得到電子生成鎂,電極反應為:Mg2++2e-=Mg;
故答案為:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)儲氫材料Mg(AlH4)2在110℃-200℃的反應為:Mg(AlH4)2=MgH2+2Al+3H2↑,反應中生成2molAl轉移電子6mol,每生成27gAl轉移電子的物質的量為3mol,
故答案為:3mol;
(4)工業上用MgC2O4•2H2O熱分解制超細MgO,當最后固體完全為MgO時,剩余固體質量占原先固體質量的百分比為:$\frac{40}{148}$×100%=27%,所以C點剩余的固體為MgO,MgC2O4•2H2O加熱后先失去結晶水,完全失去結晶水后生成MgC2O4時剩余固體質量占原先固體質量的百分比:1-$\frac{36}{148}$×100%≈75.7%,說明A點恰好失去結晶水,則B點剩余固體為氧化鎂和草酸鎂的混合物,草酸鎂中C的化合價為+3價,根據氧化還原反應特點可知,草酸鎂分解生成一氧化碳和二氧化碳氣體,反應的化學方程式為:MgC2O4$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO↑+CO2↑,
故答案為:MgC2O4$\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO↑+CO2↑;
(5)升高溫度,平衡正向移動,但是正逆反應速率是立即增大,離開原來的速率點,所以甲錯誤;
升高溫度,平衡正向移動,一氧化碳的轉化率減小,反應速率增大,溫度高的先拐,先達平衡,故乙正確;
溫度不變,增大壓強,平衡正向移動,所以CO的體積分數減小,故丙錯誤.
故答案為:乙.
點評 本題綜合考查學生熱化學、電化學、化學反應速率和平衡移動的影響因素等知識,屬于綜合知識的考查,難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | 它是烴的衍生物 | B. | 它是含有三種元素的混合物 | ||
| C. | 它的相對分子質量為32 | D. | 它在空氣中燃燒只生成CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 100mL 鹽酸 | 100mL 鹽酸 | 100mL 鹽酸 | |
| m(混合物) | 14.2g | 25g | 27.6g |
| V(CO2)(標況) | 3.36L | 4.48L | 4.48L |
| A. | 鹽酸的物質的量濃度為3.0mol•L-1 | |
| B. | 加入混合物14.2g時鹽酸不足 | |
| C. | 加入25g混合物時鹽酸過量 | |
| D. | 根據表中數據計算出混合物中NaHCO3與KHCO3的物質的量之比是1:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 14g | B. | 42g | C. | 56g | D. | 28g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com