
 2NH3↑+CaCl2+2H2O (1分)
2NH3↑+CaCl2+2H2O (1分) 4NO + 6H2O ②NH4NO3 (共4分)
4NO + 6H2O ②NH4NO3 (共4分) 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O 4NO + 6H2O
4NO + 6H2O

科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

| | 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Mg2+ | 9.5 | 11.0 |
| A.KMnO4 | B.Cl2 | C.MgO | D.CaO |
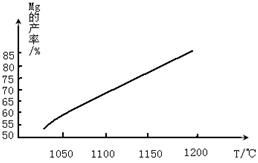
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
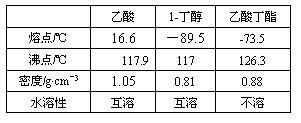

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
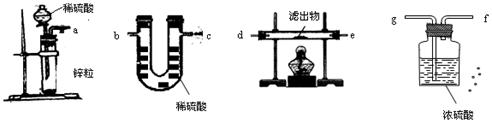
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.容器內氣體壓強保持不變 |
| B.容器內各物質的濃度不隨時間變化 |
| C.當υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1時 |
| D.1個N≡N鍵斷裂的同時,有3個H-H鍵形成 |
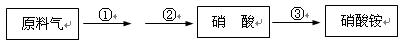
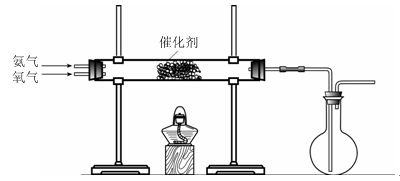
 4HNO3,原料氣為氨氣和空氣的混合物。
4HNO3,原料氣為氨氣和空氣的混合物。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
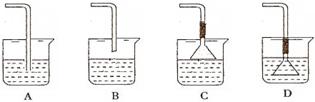
| A.對裝置甲,雙手移去后,導管中水面與燒杯水面相平,則說明裝置不漏氣 |
| B.裝置乙用于實驗室制取Cl2 |
| C.從海帶中提取碘的實驗過程中,用丙圖裝置向燒杯中放出碘的苯溶液 |
| D.丁圖裝置可用于實驗室收集甲烷氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com