
 .
.分析 W、X、Y、Z是原子序數依次增大的同一周期元素,W、X是金屬元素,Y、Z是非金屬元素.
(1)W、X各自的最高價氧化物對應的水化物可以反應生成鹽和水,可推知W為Na、X為Al;
(2)W(Na)與Y可形成化合物W2Y,Y表現-2價,則Y為S;
(3)結合原子序數可知Z為Cl,S的低價氧化物通入氯氣的水溶液中,應為二氧化硫與氯氣反應生成硫酸與HCl;
(4)同周期自左而右元素非金屬性增強,非金屬性越強,氫化物越穩定;
(5)電子層結構相同的離子,核電荷數越大離子半徑越小,離子電子層越多,離子半徑越大;
(6)Z的最高價氧化物為是Cl2O7,Cl2O7和水反應生成高氯酸.
解答 解:W、X、Y、Z是原子序數依次增大的同一周期元素,原子序數均小于18,W、X是金屬元素,Y、Z是非金屬元素.
(1)W、X為金屬,其最高價氧化物對應的水化物為堿,且兩種堿可以反應生成鹽和水,則為NaOH和Al(OH)3,二者反應的離子方程式:Al(OH)3+OH-=AlO2-+2H2O,故答案為:Al(OH)3+OH-=AlO2-+2H2O;
(2)W(Na)與Y可形成化合物W2Y,Y表現-2價,則Y為S,Na2S的電子式為: ,故答案為:
,故答案為: ;
;
(3)結合原子序數可知Z為Cl,S的低價氧化物通入氯氣的水溶液中,應為二氧化硫與氯氣反應生成硫酸與HCl,反應化學方程式為SO2+Cl2+2H2O=H2SO4+2HCl,
故答案為:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)同一周期元素中,元素的非金屬性隨著原子序數的增大而增強,元素的非金屬性越強,其氫化物越穩定,所以穩定性為HCl>H2S,
故答案為:HCl;H2S;
(5)電子層結構相同的離子,核電荷數越大離子半徑越小,離子電子層越多,離子半徑越大,故離子半徑大小順序是:S 2->Cl->Na+>Al3+,
故答案為:S 2-;Cl-;Na+;Al3+;
(6)Z的最高價氧化物為是Cl2O7,Cl2O7和水反應生成高氯酸,化學反應方程式為:Cl2O7+H2O=2HClO4,故答案為:Cl2O7+H2O=2HClO4.
點評 本題考查結構性質位置關系應用,涉及電子式、微粒半徑比較、元素周期律應用、化學方程式書寫等,正確推斷元素是解本題關鍵,注意掌握微粒半徑大小的比較方法.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH堿性比KOH強 | |
| B. | Li是最活潑的金屬,F是最活潑的非金屬 | |
| C. | X2+核外電子數目為18,則X在第四周期第ⅡA族 | |
| D. | 元素周期表有7個副族,7個主族,1個0族,1個Ⅷ族,共16個縱行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
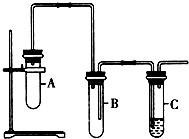 已知1,2-二氯乙烷常溫下為無色液體,沸點83.5℃,密度1.23g/mL,難溶于水,易溶于醇、醚、丙酮等有機溶劑.乙醇的沸點為78.5℃.某化學課外活動小組為探究1,2-二氯乙烷的消去反應,設計了如圖實驗裝置.請回答下列問題.
已知1,2-二氯乙烷常溫下為無色液體,沸點83.5℃,密度1.23g/mL,難溶于水,易溶于醇、醚、丙酮等有機溶劑.乙醇的沸點為78.5℃.某化學課外活動小組為探究1,2-二氯乙烷的消去反應,設計了如圖實驗裝置.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com