
 ,COS屬于極性分子(填“極性”或“非極性”).
,COS屬于極性分子(填“極性”或“非極性”).分析 (1)磷的質子數為15,原子的核外電子排布式1s22s22p63s23p3,核外有5種不同能量的電子;各電子的運動狀態不同,其最外層有5 個電子,所以5種運動狀態不同的電子,這些電子占據的軌道數為1+3=4個;
(2)氧硫化碳中,元素的非金屬性最強的元素是氧元素,在周期表中的位置為第二周期第ⅥA族;碳原子與氧氧原子、硫原子形成2對共用電子對,COS分子電子式為 ,COS分子中正負電荷中心不重合;
,COS分子中正負電荷中心不重合;
(3)1)配平化學方程式,就是通過在各物質的化學式前面添加系數,使反應中每種原子個數在反應前后相等的過程,但對于復雜的化學反應通常通過觀察,找出變化的特點或規律,常使用化合價來配平,保證化合價升高與降低的數相等即可;
2)該方程式中Cu價態由+2→+1,所以氧化劑是硫酸銅;11molPH3轉移電子為24mol,則2.2molPH3轉移電子為4.8mol;
(4)II是硫化氫與氧氧化鈉反應生成硫化鈉,反應的離子方程式為:H2S+2OH-=S2-+2H2O;
(5)依據題干信息:硫離子和水反應生成硫代硫酸根離子和氫氣,依據電荷守恒和原子守恒書寫離子反應方程式.
解答 解:(1)磷的質子數為15,原子的核外電子排布式1s22s22p63s23p3,核外有5種不同能量的電子;各電子的運動狀態不同,其最外層有5 個電子,所以5種運動狀態不同的電子,這些電子占據的軌道數為1+3=4個,故答案為:1s22s22p63s23p3;5;5;4;
(2)氧硫化碳中,元素的非金屬性最強的元素是氧元素,在周期表中的位置為第二周期第ⅥA族;碳原子與氧氧原子、硫原子形成2對共用電子對,COS分子電子式為 ,COS分子中正負電荷中心不重合,所以是極性分子,故答案為:第二周期第ⅥA族;
,COS分子中正負電荷中心不重合,所以是極性分子,故答案為:第二周期第ⅥA族; ;極性;
;極性;
(3)1)該方程式中Cu價態由+2→+1,P價態由-3→+5,為保證化合價升降數相等,Cu3P與H3PO4計量數分別為8、3,CuSO4的系數是24,H2SO4系數是24,根據元素守恒,得到:24CuSO4+11PH3+12H2O═8Cu3P↓+3H3PO4+24H2SO4,電子轉移數目為: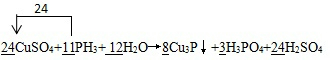 ,
,
故答案為:24,11,12,8,3,24;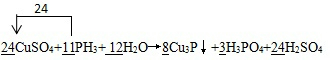 ;
;
2)該方程式中Cu價態由+2→+1,所以氧化劑是硫酸銅;11molPH3轉移電子為24mol,則2.2molPH3轉移電子為4.8mol,故答案為:硫酸銅;4.8mol;
(4)II是硫化氫與氧氧化鈉反應生成硫化鈉,硫化氫是弱電解質,反應的離子方程式為:H2S+2OH-=S2-+2H2O,故答案為:H2S+2OH-=S2-+2H2O;
(5)依據題干信息:硫離子和水反應生成硫代硫酸根離子和氫氣,根據硫原子守恒,產物需有因離子,根據原子守恒,產物還有氫氧根離子,反應為:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,故答案為:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-.
點評 本題考查學生氧化還原反應的配平以及電子轉移的計算知識,屬于綜合知識的考查,難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 應量取的濃鹽酸的體積是10.0mL | |
| B. | 若開始時潔凈的容量瓶中有少許蒸餾水,對實驗沒有影響 | |
| C. | 量取濃鹽酸時,因濃鹽酸有揮發性,所以要多量取lmL濃鹽酸 | |
| D. | 定容搖勻后,發現液面低于刻度線,應立即加少量蒸餾水補至刻度線 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
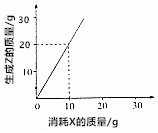
| A. | 有4g Z生成時,則消耗Y 3g | B. | X、Y、Z的摩爾質量之比為1:1:2 | ||
| C. | X、Y、Z的摩爾質量之比為2:3:2 | D. | X、Y、Z的摩爾質量之比為3:2:6 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 的化合物與 CH2=CH2 一樣,在一定條件下可聚合成高分子化合物.廣泛用作 農用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化學反應方程式是
的化合物與 CH2=CH2 一樣,在一定條件下可聚合成高分子化合物.廣泛用作 農用薄膜的聚氯乙烯塑料,是由 CH2=CH-Cl 聚合而成的,其化學反應方程式是 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 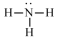 氨分子的結構式 | B. | 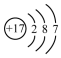 Cl-結構示意圖 | C. | 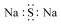 Na2S的電子式 | D. | 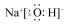 NaOH的電子式 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶用蒸餾水洗滌后未干燥即用來配制溶液 | |
| B. | 定容時,觀察液面俯視刻度線 | |
| C. | 搖勻后,液面低于刻度線,沒有再加蒸餾水 | |
| D. | 用蒸餾水洗滌燒杯和玻璃棒.并將洗滌液轉移入容量瓶中 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com