
【題目】硅是無機非金屬材料的主角,硅的氧化物和硅酸鹽約占地殼質量的90%以上。
(1)計算機芯片和太陽能電池的主要成分是________,光導纖維的主要成分是___________。
(2)工藝師常用氫氟酸來雕刻玻璃,該反應的化學方程式為__________。
(3)工業上可利用水玻璃和鹽酸反應制備硅酸凝膠后,進一步脫水處理可得到硅膠,寫出水玻璃和鹽酸反應的離子方程式_______。
(4)玉石的主要成分基本都屬于硅酸鹽,翡翠的主要成分為NaAlSi2O6,將其表示為氧化物形式為___。
(5)高純度單晶硅可以按下列方法制備:
SiO2 ![]() Si(粗)
Si(粗) ![]() SiHCl3
SiHCl3 ![]() Si(純)
Si(純)
寫出步驟①的化學方程式_______________________________________。
步驟②的產物經過冷凝后得到的SiHCl3(沸點33.0℃)中含有少量的SiCl4(沸點57.6℃),提純SiHCl3主要操作的名稱是_________。
【答案】Si SiO2 4HF+ SiO2 = SiF4 ↑+ 2H2O SiO32—+2H+=H2SiO3(膠體) Na2O·Al2O3·4SiO2 2C+ SiO2 ![]() Si+ 2CO↑ 蒸餾
Si+ 2CO↑ 蒸餾
【解析】
(1)硅單質為半導體,光導纖維成分為二氧化硅;
(2)玻璃中含有二氧化硅,二氧化硅能和氫氟酸發生反應生成四氟化硅和水;
(3)水玻璃為硅酸鈉溶液,和鹽酸反應生成硅酸膠體;
(4)根據硅酸鹽化學式可表示為:活潑金屬氧化物·金屬氧化物·非金屬氧化物·水
(5)步驟①二氧化硅與碳反應生成一氧化碳和硅;
步驟②分離沸點不同的相互溶解的液體可以使用蒸餾法;
步驟③需要在無水無氧環境下進行,硅和氧氣反應。
(1)計算機芯片和太陽能電池的主要成分是硅單質,光導纖維的主要成分是二氧化硅;
(2)玻璃中主要成分是二氧化硅,二氧化硅是酸性氧化物,能和堿反應,但也能和氫氟酸反應生成四氟化硅和水,反應方程式為SiO2+4HF=SiF4↑+2H2O;
(3)制備硅膠,工業上可利用水玻璃和鹽酸反應制備硅酸后,進一步處理可得到硅膠,寫出水玻璃和鹽酸反應的化學方程式為:2HCl+Na2SiO3=H2SiO3(膠體)+2NaCl;
(4)硅酸鹽表示為氧化物時書寫順序是:活潑金屬氧化物、較活潑金屬氧化物、二氧化硅、水,所以其化學式為Na2O·Al2O3·4SiO2;
(5)步驟①二氧化硅與碳反應生成一氧化碳和硅,2C+ SiO2 ![]() Si+ 2CO↑ ;
Si+ 2CO↑ ;
步驟②SiHCl3(沸點33.0℃)、SiCl4(沸點57.6℃)、HCl(沸點-84.7℃),他們的沸點不同,根據沸點的不同實現物質分離的方法為蒸餾或分餾;


科目:高中化學 來源: 題型:
【題目】(1)反應Fe+H2SO4=FeSO4+H2↑的能量變化趨勢,如圖所示:

①該反應為________反應(填“吸熱”或“放熱”)。
②若要使該反應的反應速率加快,下列措施可行的是________(填字母)。
A.改鐵片為鐵粉 B.改稀硫酸為98%的濃硫酸 C.升高溫度
(2)美國阿波羅宇宙飛船上使用了一種新型燃料電池,其構造如圖所示,A、B兩個電極均由多孔的碳塊組成,該電池的正極反應式為:_______________________________。

(3)300 ℃時,將A和B兩種氣體混合于恒容密閉容器中,發生如下反應:3A(g)+B(g)![]() 2C(g)+2D(g),2 min末達到平衡。
2C(g)+2D(g),2 min末達到平衡。
①300℃時,該反應的平衡常數表達式為K=________。
②已知K300℃<K350℃,則ΔH____0(填“>”或“<”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】多晶硅是單質硅的一種形態,是制造硅拋光片、太陽能電池及高純硅制晶的主要原料。已知多晶硅第三代工業制取流程如圖所示:
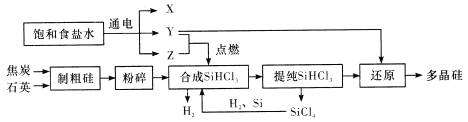
下列說法錯誤的是
A. Y、Z分別為H2、Cl2
B. 制取粗硅的過程中焦炭與石英會發生副反應生成碳化硅,在該副反應中,氧化劑與還原劑的物質的量之比為1:1
C. SiHCl3極易水解,其完全水解的產物為H2SiO3、H2、HCl,據此推測SiHCl3中硅元素的化合價為+2價
D. Y與SiHCl3制備多晶硅的反應屬于置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤化工中常需研究不同溫度下的平衡常數、投料比及產率等問題。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數隨溫度的變化如下,試回答下列問題:
CO2(g)+H2(g)的平衡常數隨溫度的變化如下,試回答下列問題:
溫度/℃ | 400 | 500 | 830 | 1000 |
平衡常數K | 10 | 9 | 1 | 0.6 |
(1)該反應的平衡常數表達式K=__________。該反應的正反應是______反應(填“放熱”或“吸熱”)。
(2)某溫度下,上述反應達到平衡后,恒容、升高溫度,原化學平衡向______反應方向移動(填“正”或“逆”),容器內混合氣體的壓強________(填“增大”、“減小”或“不變”)。
(3)能判斷該反應是否達到化學平衡狀態的依據是(_____)
a.容器中壓強不變b.混合氣體中c(CO)不變
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反應器中發生如表中的反應,按表中的物質的量投入反應混合物,其中向正反應方向進行的有__________(選填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一定量的鐵與足量的稀H2SO4及足量的CuO制單質銅,有人設計以下兩種方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若實驗過程中,根據一般的實驗方法和實驗操作規則進行操作,則對兩者制得單質銅的量作比較,正確的是
A. 相等 B. ①多 C. ②多 D. 無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知有如右圖所示轉化關系(反應條件略)。
已知;①X、Y、Z、W均為氧化物。常溫下,X是紅棕色氣體;Y能使澄清石灰水變渾濁但不能使品紅溶液褪色。②相對分子質量:甲<乙。③將甲的濃溶液露置在空氣中一段時間,質量減小濃度降低;將乙的濃溶液露置在空氣中一段時間,質量增加濃度降低。請完成下列空白:

(1)Z是(寫化學式):______________。
(2)將乙的濃溶液露置在空氣中一段時間,質量增加濃度降低,表明乙的濃溶液具有__________性。利用這種性質可以進行__________項(填字母)實驗操作。
A.鈍化鐵片 B.檢驗Ba2+ C.干燥氨氣 D.干燥氯氣
(3)在X與Z的反應中,被氧化的X與被還原的X的物質的量之比是________________。
(4)W可用于工業制溴過程中吸收潮濕空氣中的Br2,寫出該反應的離子方程式:______________。該反應很好地解決了環保問題,但給工業生產帶來了_______________的問題。
(5)寫出M與甲的濃溶液在加熱條件下反應的化學方程式:______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4·6H2O是一種綠色易溶于水的晶體,可由電鍍廢渣(除鎳外,還含有銅、鋅、鐵等元素)為原料獲得。操作步驟如下:
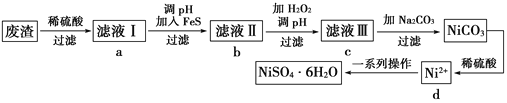
(1)向濾液Ⅰ中加入FeS是為了生成難溶于酸的硫化物沉淀而除去Cu2+、Zn2+等雜質,則除去Cu2+的離子方程式為___________________________________。
(2)對濾液Ⅱ的操作,請回答:
①往濾液Ⅱ中加入H2O2的離子方程式為________________________________。
②調濾液ⅡpH的目的是除去Fe3+,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,已知25 ℃時Ksp[Fe(OH)3]=2.8×10-39,則該溫度下上述反應的平衡常數K=________________。
Fe(OH)3+3H+,已知25 ℃時Ksp[Fe(OH)3]=2.8×10-39,則該溫度下上述反應的平衡常數K=________________。
③檢驗Fe3+是否除盡的操作和現象是__________________________________________。
(3)濾液Ⅲ中溶質的主要成分是NiSO4,加Na2CO3過濾后得到NiCO3固體,再加適量稀硫酸溶解又生成NiSO4,這兩步操作的目的是___________________。
(4)得到的NiSO4溶液經蒸發濃縮、冷卻結晶、過濾等一系列操作可得到NiSO4·6H2O,請回答:
①在進行蒸發濃縮操作時,加熱到___________________________(描述實驗現象)時,則停止加熱。
②為了提高產率,過濾后得到的母液要循環使用,則應該回流到流程中的________位置(選填a、b、c、d)。
③如果得到產品的純度不夠,則應該進行________(填操作名稱)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定量的銅粉投入FeCl3溶液中,兩者恰好完全反應,完成下列問題.
(1)寫出該反應的離子方程式_______________________________
(2)該反應中的氧化劑是_______,氧化產物和還原產物的物質的量之比為________
(3)若反應過程中轉移了0.2mol電子,則溶解消耗的銅的質量為 ________
(4)如何檢驗反應后的溶液中是否含有Fe3+________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在粗制CuSO4·5H2O晶體中常含有雜質Fe2+。在提純時為了除去Fe2+,常加入合適氧化劑,使Fe2+氧化為Fe3+,下列物質可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入適當物質調整至溶液pH=4,使Fe3+轉化為Fe(OH)3,可以達到除去Fe3+而不損失CuSO4的目的,調整溶液pH可選用下列中的___________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同學懷疑調整至溶液pH=4是否能達到除去Fe3+而不損失Cu2+的目的,乙同學認為可以通過計算確定,他查閱有關資料得到如下數據,常溫下Fe(OH)3的溶度積Ksp=8.0×10-38,Cu(OH)2的溶度積Ksp=3.0×10-20,通常認為殘留在溶液中的離子濃度小于1×10-5 mol·L-1時就認為沉淀完全,設溶液中CuSO4的濃度為3.0 mol·L-1,則Cu(OH)2開始沉淀時溶液的pH為________,Fe3+完全沉淀時溶液的pH為________,通過計算確定上述方案________(填“可行”或“不可行”)。
(3)某學習小組用“間接碘量法”測定含有CuCl2·2H2O晶體的試樣(不含能與I-發生反應的氧化性雜質)的純度,過程如下:取0.800 g試樣溶于水,加入過量KI固體,充分反應,生成CuI白色沉淀。用0.100 0 mol·L-1 Na2S2O3標準溶液滴定,到達滴定終點時,消耗Na2S2O3標準溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可選用________________作滴定指示劑,滴定終點的現象是________________________。
②CuCl2溶液與KI反應的離子方程式為_______________________________________。
③該試樣中CuCl2·2H2O的質量百分數為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com