
| A. | 3mL | B. | 7.5mL | C. | 15mL | D. | 17.5mL |
分析 AlCl3和NaOH反應與NaOH的量的多少有關,當NaOH不足時生成Al(OH)3,當堿過量時,則生成NaAlO2.現AlCl3的物質的量為0.03mol,完全生成Al(OH)3沉淀時,沉淀質量應為2.34g,現沉淀質量為0.78g,說明有兩種情況:一為沉淀不完全,只生成Al(OH)3沉淀;另一種情況為沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
解答 解:現AlCl3的物質的量為0.03mol,完全生成Al(OH)3沉淀時,沉淀質量應為2.34g,現沉淀質量為0.78g,說明有兩種情況:一為沉淀不完全,只生成Al(OH)3沉淀;另一種情況為沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n(Al(OH)3)=$\frac{0.78g}{78g/mol}$=0.01mol,
①若堿不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物質的量為0.01mol×3=0.03mol,
加入NaOH溶液的體積為$\frac{0.03mol}{4mol/L}$=0.0075L,即7.5mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
則由 Al3++3OH-═Al(OH)3↓
0.03mol 0.09mol 0.03mol
Al(OH)3+OH-═AlO2-+2H2O
(0.03-0.01)mol (0.03-0.01)mol
則消耗的堿的物質的量為0.09mol+(0.03-0.01)mol=0.11mol,
加入NaOH溶液的體積為$\frac{0.11mol}{4mol/L}$=0.0275L,即27.5mL;
故選B.
點評 本題考查鋁的計算,題目難度中等,本題的解答關鍵是根據題意確定發生反應的情況,結合反應的有關方程式計算.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數的變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X是短周期元素中原子半徑最大的;Y的單質是一種常見的半導體材料;Z的非金屬性在同周期元素中最強.下列說法不正確的是( )
W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數的變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X是短周期元素中原子半徑最大的;Y的單質是一種常見的半導體材料;Z的非金屬性在同周期元素中最強.下列說法不正確的是( )| A. | 簡單離子半徑:W>X>Z | |
| B. | 最簡單氣態氫化物的穩定性:Y<Z | |
| C. | 化合物XZW中既含離子鍵又含共價鍵 | |
| D. | Y的氧化物能與X的最高價氧化物對應的水化物反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃時反應C(g)+D(g)?A(g)+B(g)的平衡常數K=0.4 | |
| B. | 反應達平衡后,升高溫度,平衡正向移動 | |
| C. | 4s內,用A表示的該反應的平均反應速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反應達平衡時,B的轉化率為20% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50 mL 12 mol/L鹽酸與足量MnO2共熱,轉移的電子數為0.3NA | |
| B. | 2 L 0.5 mol•L-1亞硫酸溶液中含有的H+離子數為2NA | |
| C. | 過氧化鈉與水反應時,生成0.1 mol氧氣轉移的電子數為0.2NA | |
| D. | 密閉容器中2 mol NO與1 mol O2充分反應,產物的分子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
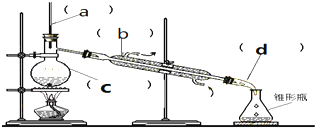
| A. | 儀器C是圓底燒瓶,加熱時,液體量不超過容積的$\frac{2}{3}$,不少于容積的$\frac{1}{3}$ | |
| B. | 儀器b是直型冷凝管 | |
| C. | 儀器b中冷卻水的進出方向是“下進上出” | |
| D. | 進行蒸餾操作時,溫度計的下端不能放在液面以下 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 氣體A是NO | |
| B. | X中不能確定的離子是 A13+和C1ˉ | |
| C. | 溶液E和氣體F能發生化學反應 | |
| D. | X中肯定存在Fe2+、A13+、NH4+、SO42ˉ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com