
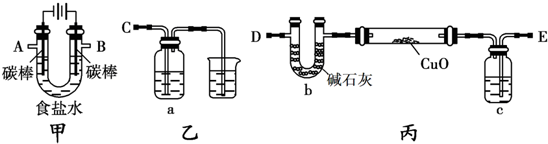
分析 (1)甲裝置電解飽和食鹽水,左側碳棒連接電源負極,為陰極,右側碳棒連接電源正極,為陽極,溶液中氯離子在陽極上失電子生成氯氣,氫離子在陰極得到電子生成氫氣,陰極附近氫氧根離子濃度增大,遇到酚酞溶液變紅色;
(2)甲裝置中B口導出的氣體為氯氣,用氫氧化鈉溶液吸收氯氣,反應生成氯化鈉、次氯酸鈉與水;
(3)通過測定丙裝置中除硬質玻璃管外的某裝置前后質量差來計算飽和食鹽水的電解率,是利用U形管測定氫氣還原氧化銅過程中生成的水蒸氣,要防止外界空氣中的水蒸氣等被U形管中堿石灰吸收,結合氫氣還原氧化銅時,氫氣不能全部反應來考慮;
(4)根據溶液pH計算氫氧根離子濃度,結合化學方程式計算反應的氯化鈉質量,計算200ml溶液中氯化鈉的質量,用反應的氯化鈉質量除以原溶液中氯化鈉質量得到食鹽水的電解率.
解答 解:(1)甲裝置電解飽和食鹽水,左側碳棒連接電源負極,為陰極,右側碳棒連接電源正極,為陽極,溶液中氯離子在陽極上失電子生成氯氣,氫離子在陰極得到電子生成氫氣,陰極附近氫氧根離子濃度增大,遇到酚酞溶液變紅色,電解氯化鈉的總反應為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$Cl2↑+2H2↑+2OH-,
故答案為:2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$Cl2↑+2H2↑+2OH-;左;
(2)甲裝置中B口導出的氣體為氯氣,用氫氧化鈉溶液吸收氯氣,則裝置B連C,反應生成氯化鈉、次氯酸鈉與水,離子方程式為:Cl2+2OH-=H2O+Cl-+ClO-,
故答案為:B;C;Cl2+2NaOH=H2O+NaCl+NaClO;
(3)利用甲、丙裝置測定飽和食鹽水的電解率,通過測定丙裝置中除硬質玻璃管外的某裝置前后質量差來計算飽和食鹽水的電解率,是利用U形管測定氫氣還原氧化銅過程中生成的水蒸氣,裝置中添加一干燥裝置防止外界空氣中的水蒸氣的干擾,c中應該盛的試劑是濃硫酸,氫氣還原氧化銅時,氫氣不能全部反應,所以該方案測得的實驗結果不準確,故答案為:濃硫酸;氫氣還原氧化銅時,氫氣不能全部反應,誤差太大;
(4)若電解200mL飽和食鹽水一段時間,測得溶液的為pH為14,則c(H+)=10-14mol/L,c(OH-)=1mol/L,氫氧根離子物質的量=0.2L×1mol/L=0.2mol,由2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑可知,電解的氯化鈉物質的量為0.2mol,其質量=0.2mol×58.5g/mol=11.7g,$\frac{11.7g}{58.5g}$×100%=20%,
故答案為:20%.
點評 本題考查電解原理應用、定量測定實驗、對裝置的分析評價等,關鍵是對實驗原理的理解,側重考查學生對基礎知識的遷移應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 實驗序號 | 甲 | 乙 | 丙 |
| 合金質量/mg | 255 | 385 | 459 |
| 生成氣體體積/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體的平均分子量不再變化 | B. | 反應的平衡常數不變 | ||
| C. | ?(H2)=2 ?(HI) | D. | 氣體的顏色不再變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 5.6LN2(標準狀況)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (標準狀況)和0.1molN2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
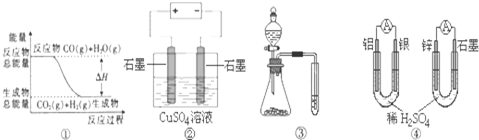
| A. | 圖①表示可逆反應“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | |
| B. | 圖②為電解硫酸銅溶液的裝置,一定時間內,兩電極產生單質的物質的量之比一定為1:1 | |
| C. | 圖③實驗裝置可完成比較磷酸、碳酸、苯酚的酸性強弱的實驗 | |
| D. | 圖④兩個裝置中通過導線的電子數相同時,消耗負極材料的物質的量也相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 純堿溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 銅與濃硫酸共熱產生氣體:Cu+2H2SO4(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 鐵釘在潮濕的空氣中很快被腐蝕:Fe-3e-═Fe3+ | |
| D. | 氨氣遇到氯化氫時產生白煙:NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 50mL鹽酸 | 50mL鹽酸 | 50mL鹽酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(標況) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應速率是化學反應進行快慢程度的物理量 | |
| B. | 化學反應速率通常用單位時間內生成或消耗某物質的質量的多少來表示 | |
| C. | 在同一個反應中,可以用反應物或生成物來表示反應速率 | |
| D. | 化學反應速率的常用單位有mol/(L•s)和mol/(L•min) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com