
| A. | 根據弱酸越稀越電離的規律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根據主族元素最高正化合價與族序數的關系,推出鹵族元素最高正價都是+7 | |
| C. | 根據溶液的pH與溶液酸堿性的關系,推出pH=6.8的溶液一定顯酸性 | |
| D. | 根據較強酸可以制取較弱酸的規律,推出CO2通入NaClO溶液中能生成HClO |
分析 A.0.2mol•L-1 CH3COOH的pH值與0.1mol•L-1 CH3COOH的 pH值比較大小,與氫離子濃度大小有關;
B.F只有負價;
C.常溫下pH=6.8的溶液一定顯酸性;
D.CO2通入NaClO溶液中能生成HClO,發生強酸制取弱酸的反應.
解答 解:A.0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值小,與氫離子濃度大小有關,0.1mol/L的醋酸溶液電離程度大,但氫離子濃度小,故A錯誤;
B.F只有負價,除F外鹵族元素最高正價都是+7,故B錯誤;
C.常溫下pH=6.8的溶液一定顯酸性,但Kw與溫度有關,溫度未知,不能確定pH=6.8的溶液的酸堿性,故C錯誤;
D.CO2通入NaClO溶液中能生成HClO,發生強酸制取弱酸的反應,根據“規律”可推出結論,故D正確;
故選D.
點評 本題考查化學反應中的規律及應用,為高頻考點,把握反應原理、規律應用等為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:解答題
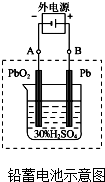 (1)鉛蓄電池是典型的可充型電池,電池總反應式為:Pb+PbO2+4H++2SO42-$?_{充電}^{放電}$2PbSO4+2H2O
(1)鉛蓄電池是典型的可充型電池,電池總反應式為:Pb+PbO2+4H++2SO42-$?_{充電}^{放電}$2PbSO4+2H2O查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | 與Fe反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| D. | 水電離的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應①②中的氧化劑分別是Sb2S3、Sb4O6 | |
| B. | 反應①中每生成3 mol FeS時,共轉移6 mol電子 | |
| C. | 反應②說明高溫下Sb的還原性比C強 | |
| D. | 每生成4 mol Sb時,反應①與反應②中還原劑的物質的量之比為4:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含有-OH的有機化合物性質相同 | |
| B. | 鍋爐水垢中的CaSO4可用飽和Na2CO3溶液處理,使之轉化為CaCO3后再用鹽酸除去 | |
| C. | 鈉的金屬性比鉀強,工業上用鈉制取鉀(Na+KCl$\frac{\underline{\;850℃\;}}{\;}$K↑+NaCl) | |
| D. | 既有單質參加,又有單質生成的反應一定是氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 太陽能的開發利用在新能源研究中占據重要地位,單晶硅太陽能電池片在加工時,一般摻雜微量的銅、锎、硼、鎵、硒等.回答下列問題:
太陽能的開發利用在新能源研究中占據重要地位,單晶硅太陽能電池片在加工時,一般摻雜微量的銅、锎、硼、鎵、硒等.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 酸性溶液中KIO3與KI反應生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | Na2CO3溶液中CO32-的水解:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com