
| A. | 容器內壓強增大 | B. | KO2的量保持不變 | C. | 平衡常數減小 | D. | 氧氣濃度不變 |
分析 對于反應4KO2(s)?2K2O(s)+3O2(g),達到平衡后,保持溫度不變,縮小容器體積,相當于增大壓強,平衡逆向移動,化學平衡常數只與溫度有關,據此分析解答.
解答 解:A.縮小容器體積,相當于增大壓強,平衡向逆反應方向移動,化學平衡常數=c(O2)3,溫度不變,化學平衡常數不變,則氧氣濃度不變,所以壓強不變,故A錯誤;
B.平衡向逆反應方向移動,則KO2量增加,故B錯誤;
C.化學平衡常數只與溫度有關,溫度不變,平衡常數不變,故C錯誤;
D.化學平衡常數=c(O2)3,溫度不變,化學平衡常數不變,則氧氣濃度不變,故D正確;
故選D.
點評 本題考查了可逆反應平衡移動,根據壓強與平衡移動方向之間的關系分析解答即可,注意平衡常數只與溫度有關,與物質濃度無關,為易錯點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在101 kPa時,1 mol H2完全燃燒生成氣態水,放出285.8 kJ熱量,H2的燃燒熱為285.8 kJ•mol-1 | |
| B. | 測定HCl和NaOH反應的中和熱時,每次實驗均應測量3個溫度,即鹽酸起始溫度,NaOH起始溫度和反應后終止溫度 | |
| C. | 在101 kPa時,1 mol C與適量O2反應生成1 mol CO時,放出110.5 kJ熱量,則C的燃燒熱為110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若將含0.5 mol H2SO4的濃硫酸與含1 mol NaOH的溶液混合,放出的熱量等于57.3 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往反應后的溶液中加入AgNO3溶液檢驗是否有Br-生成 | |
| B. | 實驗中觀察不到有氣體生成 | |
| C. | 生成的氣體可直接通入到溴水中檢驗是否有乙烯生成 | |
| D. | 生成的氣體可直接通入到酸性高錳酸鉀溶液中檢驗是否有乙烯生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 步驟①中當v正(CrO42-)=2v逆(Cr2O72-)時,說明反應:2CrO42-+2H+?Cr2O72-+H2O 達到平衡狀態 | |
| B. | 若向K2Cr2O7溶液中加NaOH濃溶液,溶液可由橙色變黃色 | |
| C. | 步驟②中,若要還原1 mol Cr2O72-離子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步驟③中,當將溶液的pH 調節至5 時,可認為廢水中的鉻元素已基本除盡(當溶液中c(Cr3+)≤10-5 mol/L時,可視作該離子沉淀完全) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互為同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核內的中子數與核外電子數之差為32 | |
| C. | 元素周期表中L層電子為奇數的元素所在族序數與該元素原子的L層電子數相等 | |
| D. | 1 mol KHSO4加熱熔化可電離出2NA個陽離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
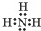 ;NH3在同族元素形成的氫化物中具有較高的沸點,其原因是NH3分子間有氫鍵.
;NH3在同族元素形成的氫化物中具有較高的沸點,其原因是NH3分子間有氫鍵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na20和SiO2熔化 | B. | 冰和金剛石熔化 | ||
| C. | 氯化鈉和蔗糖熔化 | D. | 碘和干冰升華 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
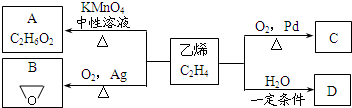 乙烯有如下轉化關系.乙烯在不同的條件下可被氧化成不同產物,如A、B、C.已知:取0.01mol A與足量的鈉完全反應后,生成224mL(標準狀況)氣體.C是B的同分異構體,C與新制的氫氧化銅濁液一起加熱,會產生紅色沉淀.
乙烯有如下轉化關系.乙烯在不同的條件下可被氧化成不同產物,如A、B、C.已知:取0.01mol A與足量的鈉完全反應后,生成224mL(標準狀況)氣體.C是B的同分異構體,C與新制的氫氧化銅濁液一起加熱,會產生紅色沉淀.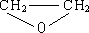 +H2O$\stackrel{一定條件}{→}$
+H2O$\stackrel{一定條件}{→}$ .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com