
(14分)(1)二氧化硫的催化氧化的過程如圖所示,

其中a、c二步的化學方程式可表示為:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2)壓強及溫度對SO2轉化率的影響如下表(原料氣各成分的體積分數為:SO2 7%,O2 11%,N2 82%):
|
壓強/MPa 溫度/℃ |
0.1[ |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
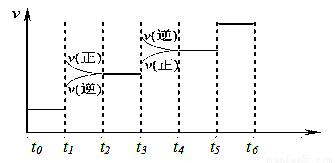
當合成SO3的反應達到平衡后,改變某一外界條件(不改變SO2、O2和SO3的量),反應速率與時間的關系如圖所示。圖中t1 時引起平衡移動的條件可能是 其中表示平衡混合物中SO3的含量最高的一段時間是 。
(3)550 ℃時,SO2轉化為SO3的平衡轉化率(α)與體系總壓強(p)的關系如右圖所示。將2.0
mol SO2和1.0
mol O2置于5 L密閉容器中,反應達平衡后,體系總壓強為0.10
M Pa。試計算反應2SO3 2SO2+O2 在550 ℃時的平衡常數K=
。
2SO2+O2 在550 ℃時的平衡常數K=
。

反應達平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度 B.充入He(g),使體系總壓強增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,將x mol·L-1的氨水與y mol·L-1的硫酸等體積混合,反應后溶液中顯中性,則c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代數式表示出氨水的電離平衡常數 。
(1)V2O5 (2)增大壓強、t2—t3 (3)0.0025 C D (4)= K=2×10-7y /(x-2y)
【解析】(1)將abc三個反應相疊加,即得到2SO2+O2 2SO3,因此V2O5其催化劑作用。
2SO3,因此V2O5其催化劑作用。
(2)t1 時正逆反應速率都增大,但正反應速率大于逆反應速率,說明平衡向正反應方向移動,所以改變的條件是增大壓強。由于t3時逆反應速率大于正反應速率,平衡向逆反應方向移動,所以平衡混合物中SO3的含量最高的一段時間是t2—t3。
(3)反應達平衡后,體系總壓強為0.10 M Pa,此時轉化率是0.80,所以生成三氧化硫是1.6mol,則平衡時二氧化硫和氧氣分別是0.4mol、0.2mol,所以平衡常數K= ,則反應2SO3
,則反應2SO3 2SO2+O2 在550 ℃時的平衡常數K=1/400=0.0025。反應是放熱反應,所以升高溫度平衡向逆反應方向移動,n(SO3)/n(SO2)減小。充入He(g),使體系總壓強增大,但物質的濃度不變,所以平衡不移動。C、D都相當于增大壓強,平衡向正反應方向移動,所以n(SO3)/n(SO2)增大,答案選CD。
2SO2+O2 在550 ℃時的平衡常數K=1/400=0.0025。反應是放熱反應,所以升高溫度平衡向逆反應方向移動,n(SO3)/n(SO2)減小。充入He(g),使體系總壓強增大,但物質的濃度不變,所以平衡不移動。C、D都相當于增大壓強,平衡向正反應方向移動,所以n(SO3)/n(SO2)增大,答案選CD。
(4)根據電荷守恒c(NH4+)+c(H+)= 2c(SO42-)+c(OH-)可知,當溶液顯中性時c(NH4+)= 2c(SO42-)=ymol/L。根據氮原子守恒可知,溶液中c(NH3·H2O)=(x/2-y)mol,所以平衡常數= =2×10-7y
/(x-2y)。
=2×10-7y
/(x-2y)。


科目:高中化學 來源:2012-2012學年廣東省揭陽一中高二下學期第一次階段考試化學試卷 題型:填空題
(14分)(1)二氧化硫的催化氧化的過程如圖所示,其中a、c二步的化學方程式可表示為: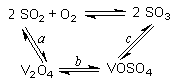
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2)550 ℃時,SO2轉化為SO3的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應達平衡后,體系總壓強為0.10 M Pa。試計算反應2SO3 2SO2+O2在550 ℃時的平衡常數K= 。
2SO2+O2在550 ℃時的平衡常數K= 。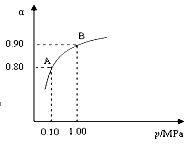
(3)550 ℃時,將2.0 mol SO2和1.0 mol O2置于5L密閉容器中,反應達平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度 B.充入He(g),使體系總壓強增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)維持溫度不變條件下使之發生如下反應:2SO2+O2 2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。
2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。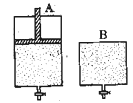
試填寫下列空格:
A容器達到平衡時所需的時間比B容器__ _(填:“短”或“長”);平衡時A容器中SO2的轉化率比B容器_______(填:“大”或“小”);達到所述平衡后,若向兩容器中通入等物質的量的原反應氣體,達到平衡時,A容器的混合氣體中SO3的體積分數_________(填“增大”、“減小”或“不變”,下同);B容器的混合氣體中SO3的體積分數_________。
查看答案和解析>>
科目:高中化學 來源:2012屆江西省重點中學高三第二次聯考理綜化學試卷(帶解析) 題型:填空題
(14分)(1)二氧化硫的催化氧化的過程如圖所示,
其中a、c二步的化學方程式可表示為:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2)壓強及溫度對SO2轉化率的影響如下表(原料氣各成分的體積分數為:SO2 7%,O2 11%,N2 82%):
| 壓強/MPa 溫度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

 2SO2+O2 在550 ℃時的平衡常數K= 。
2SO2+O2 在550 ℃時的平衡常數K= 。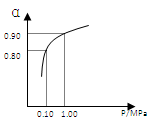
查看答案和解析>>
科目:高中化學 來源:2013-2014學年貴州省六校聯盟高三第一次聯考化學試卷(解析版) 題型:填空題
(1)二氧化硫的催化氧化的過程如圖所示,其中a、c二步的化學方程式可表示為:

SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2) 550 ℃時,SO2轉化為SO3的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應達平衡后,體系總壓強為0.10 M Pa。試計算反應2SO3 2SO2+O2
在550 ℃時的平衡常數K= 。
2SO2+O2
在550 ℃時的平衡常數K= 。

(3)550 ℃時,將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應 達平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度
B.充入He(g),使體系總壓強增大
C.再充入2 mol SO2和1 mol O2
D.再充入1 mol SO2和1 mol O2
(4)維持溫度不變條件下使之發生如下反應:2SO2+O2 2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。
2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。

試填寫下列空格:
A容器達到平衡時所需的時間比B容器__________(填:“短或長”);平衡時A容器中SO2的轉化率比B容器_______(填:“大或小”);達到所述平衡后,若向兩容器中通入等物質的量的原反應氣體,達到平衡時,A容器的混合氣體中SO3的體積分數_________(填“增大”、“減小”或“不變”,下同);B容器的混合氣體中SO3的體積分數_________。
查看答案和解析>>
科目:高中化學 來源:2012-2012學年廣東省高二下學期第一次階段考試化學試卷 題型:填空題
(14分)(1)二氧化硫的催化氧化的過程如圖所示,其中a、c二步的化學方程式可表示為:
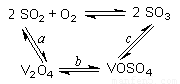
SO2+V2O5 SO3+
V2O4
SO3+
V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
該反應的催化劑是 (寫化學式)
(2)550 ℃時,SO2轉化為SO3的平衡轉化率(α)與體系總壓強(p)的關系如圖所示。將2.0 mol SO2和1.0 mol O2置于5 L密閉容器中,反應達平衡后,體系總壓強為0.10 M Pa。試計算反應2SO3 2SO2+O2 在550 ℃時的平衡常數K=
。
2SO2+O2 在550 ℃時的平衡常數K=
。

(3)550 ℃時,將2.0 mol SO2和1.0 mol O2置于5L密閉容器中,反應達平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高溫度 B.充入He(g),使體系總壓強增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)維持溫度不變條件下使之發生如下反應:2SO2+O2 2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。
2SO3,有兩只密閉容器A和B。A容器有一個可以移動的活塞能使容器內保持恒壓,B容器能保持恒容。起始時向這兩個容器中分別充入等物質的量的體積比為2∶1的SO2和O2的混合氣體,并使A和B容積相等(如下圖所示)。

試填寫下列空格:
A容器達到平衡時所需的時間比B容器__ _(填:“短”或“長”);平衡時A容器中SO2的轉化率比B容器_______(填:“大”或“小”);達到所述平衡后,若向兩容器中通入等物質的量的原反應氣體,達到平衡時,A容器的混合氣體中SO3的體積分數_________(填“增大”、“減小”或“不變”,下同);B容器的混合氣體中SO3的體積分數_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com