
| 序號 | 實驗事實 | 結論 |
| A | SO3的水溶液可以導電 | SO3是電解質 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | Ca(ClO)2溶液中通入CO2產生白色沉淀 | 酸性:H2CO3>HClO |
| D | 用鉑絲蘸取某溶液在酒精燈火焰上灼燒直接觀察火焰顏色,未見紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO3是非電解質;
B.能和硝酸酸化的氯化鋇溶液反應生成白色沉淀的離子還有SO32-、Ag;
C.發生強酸制取弱酸的反應;
D.通過焰色反應檢驗鉀離子時,觀察火焰顏色時需要通過藍色的鈷玻璃觀察.
解答 解:A.溶液導電,原因是SO3和水反應生成硫酸,SO3不能電離出離子,為非電解質,故A錯誤;
B.能和硝酸酸化的氯化鋇溶液反應生成白色沉淀的離子有SO42-、SO32-、Ag+,故B錯誤;
C.將CO2通入Ca(ClO)2到溶液中產生白色沉淀碳酸鈣,在溶液中發生強酸制取弱酸的反應,則酸性為H2CO3>HClO,故C正確;
D.實驗室檢驗K+的存在用焰色反應,可以觀察到紫色火焰,但要通過藍色鈷玻璃觀察,以便濾去黃色光,避免干擾,故D錯誤.
故選C.
點評 本題考查較為綜合,涉及物質的檢驗和性質的比較,綜合考查學生的分析能力、實驗能力和評價能力,為高考常見題型,注意把握物質的性質的異同以及實驗的嚴密性和可行性的評價,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 用pH試紙測定溶液的pH時,需先用蒸餾水潤濕試紙,并測得某溶液pH為3.1 | |
| B. | 中和pH與體積均相同的NaOH溶液和氨水,結果消耗H2SO4的物質的量一樣多 | |
| C. | 酸堿中和滴定的終點是指酸和堿恰好完全反應,此時溶液一定呈中性 | |
| D. | 在HCl氣氛中蒸干AlCl3溶液能到得純凈的無水氯化鋁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵與足量氯氣反應,1mol Fe失去電子數為3NA | |
| B. | 標準狀況下,22.4LH2O所含的分子數為NA | |
| C. | 1molNH3所含原子數為NA | |
| D. | 0.5L 0.2 mol•L-1硫酸鈉溶液中含有的SO42-離子數目為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
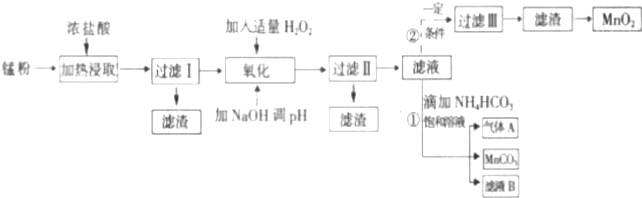
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀開始時pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全時pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com