
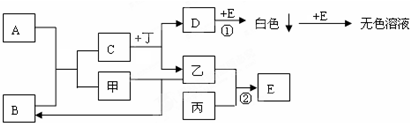
分析 A是淡黃色固體,B是無色液體,二者反應生成C與單質甲,且C的焰色反應呈黃色,可知A是Na2O2,B是H2O,甲、乙、丙為非金屬單質,甲是O2,C是NaOH.丁為地殼中含量最多的金屬元素所組成的單質,則丁是Al,與NaOH反應生成單質乙,則乙是H2,D是NaAlO2.丙是黃綠色氣體單質,則丙是Cl2,由轉化關系可知E是HCl,白色沉淀為氫氧化鋁,據此解答.
(1)實驗室制取氯氣是利用二氧化錳和濃鹽酸加熱反應生成;
(2)反應①為鹽酸與偏鋁酸鈉溶液反應生成氫氧化鋁沉淀、氯化鈉與水;
(3)分析可知A是Na2O2,B是H2O,過氧化鈉和水反應生成氫氧化鈉和氧氣;
(4)該溫度下,將0.1mol/L的AlCl3溶液調整到pH=5,計算此時氫氧根離子濃度,結合溶度積常數計算得到鋁離子濃度.
解答 解:A是淡黃色固體,B是無色液體,二者反應生成C與單質甲,且C的焰色反應呈黃色,可知A是Na2O2,B是H2O,甲、乙、丙為非金屬單質,甲是O2,C是NaOH.丁為地殼中含量最多的金屬元素所組成的單質,則丁是Al,與NaOH反應生成單質乙,則乙是H2,D是NaAlO2.丙是黃綠色氣體單質,則丙是Cl2,由轉化關系可知E是HCl,白色沉淀為氫氧化鋁,
(1)實驗室制取氯氣的化學反應為二氧化錳和濃鹽酸加熱反應生成氯氣、氯化錳和水,反應的離子方程式為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故答案為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)反應①為鹽酸與偏鋁酸鈉溶液反應生成氫氧化鋁沉淀、氯化鈉與水,反應的化學方程式為:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,
故答案為:NaAlO2+HCl+H2O=NaCl+Al(OH)3↓;
(3)分析可知A是Na2O2,B是H2O,過氧化鈉和水反應生成氫氧化鈉和氧氣,反應的化學方程式為:2Na2O2+2H2O=4NaOH+O2↑,
故答案為:2Na2O2+2H2O=4NaOH+O2↑;
(4)常溫下,將0.1mol/L的AlCl3溶液調整到pH=5,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=3.0×10-34.此時溶液中c(Al3+)=$\frac{3.0×1{0}^{-34}}{(1{0}^{-9})^{3}}$=3.0×10-7mol/L,故答案為:3.0×10-7mol/L.
點評 本題考查無機物的推斷,涉及Na、Al、Cl鹽酸單質化合物性質以及電解、氣體制備等,題目難度中等,注意根據物質的顏色、反應的現象為突破口進行推斷,學習中注意元素化合物的性質,注重相關知識的積累.


科目:高中化學 來源: 題型:選擇題

| A. | H2S是一種弱電解質 | |
| B. | 可用石灰乳吸收H2S氣體 | |
| C. | 根據如圖可知FeCl3、CuCl2均能氧化H2S | |
| D. | H2S在空氣中燃燒可以生成SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈹是一種輕金屬,它的氧化物對應水化物可能是兩性 | |
| B. | 砹是一種有色固體,它的氣態氫化物很不穩定,砹化銀是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸鍶難溶于水和稀HNO3,其氫氧化物為強堿 | |
| D. | 硒化氫是無色無味氣體,沒有H2S穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 或
或  ,兩者是等同的.苯并[α]芘是強致癌物質(存在于煙囪灰、煤焦油、燃燒的煙霧和內燃機的尾氣中).它的分子由5個苯環并合而成,其結構可以表示為(Ⅰ)或(Ⅱ)式,這兩者也是等同的:
,兩者是等同的.苯并[α]芘是強致癌物質(存在于煙囪灰、煤焦油、燃燒的煙霧和內燃機的尾氣中).它的分子由5個苯環并合而成,其結構可以表示為(Ⅰ)或(Ⅱ)式,這兩者也是等同的: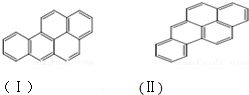
| A. | 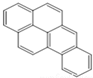 | B. | 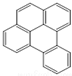 | C. | 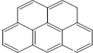 | D. | 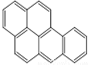 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | BOH溶于水,其電離方程式是BOH═B++OH- | |
| B. | 若將一定量的上述溶液混合后pH=7,則c(A- )=c(B+) | |
| C. | 在0.1 mol/L BA溶液中,c(B+)>c(A- )>c(OH- )>c(H+) | |
| D. | 若將0.1 mol/L BOH溶液稀釋至0.001 mol/L,則溶液的pH=9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定有乙烯 | B. | 可能有乙烯 | C. | 一定沒有甲烷 | D. | 可能有乙烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4H是離子化合物 | |
| B. | NH4H溶于水形成的溶液呈堿性 | |
| C. | NH4H與水反應時,NH4H是氧化劑 | |
| D. | NH4H固體投入少量水中,可能有兩種氣體產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
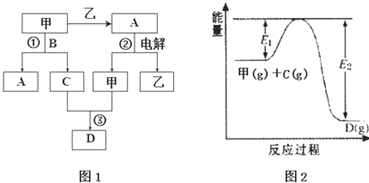
| 容器編號 | n(甲) | n(C) | n(D) | v正與v逆的關系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com