
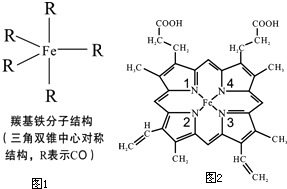
 Fe、C、N、O、H可以組成多種物質(zhì).回答以下問(wèn)題:
Fe、C、N、O、H可以組成多種物質(zhì).回答以下問(wèn)題:分析 (1)根據(jù)Fe的外圍電子排布分析;
(2)①根據(jù)CO的結(jié)構(gòu)式C≡O(shè)分析;
②電負(fù)性弱的吸引電子能力弱,易提供孤對(duì)電子形成配位鍵;
③由圖1可知羰基鐵分子為三角雙錐中心對(duì)稱(chēng)結(jié)構(gòu),正負(fù)電荷中心重疊屬于非極性分子;
(3)根據(jù)分子中的孤對(duì)電子產(chǎn)生排斥作用強(qiáng)于成對(duì)電子來(lái)分析;
(4)①分子間存在范德華力,分子中含有羧基能形成氫鍵;
②根據(jù)N原子的共價(jià)鍵數(shù)目分析.
解答 解:(1)Fe為26號(hào)元素,F(xiàn)e的外圍電子排布3d64s2,在3d軌道上有4個(gè)未成對(duì)電子,故答案為:4;
(2)①CO的結(jié)構(gòu)式C≡O(shè),三鍵中含有1個(gè)σ鍵和2個(gè)π鍵,則CO分子中σ鍵與π鍵數(shù)目之比為1:2,故答案為:1:2;
②電負(fù)性弱的吸引電子能力弱,易提供孤對(duì)電子形成配位鍵,則Fe(CO)5中與Fe形成配位鍵的是碳原子,故答案為:碳;
③由圖1可知羰基鐵分子為三角雙錐中心對(duì)稱(chēng)結(jié)構(gòu),正負(fù)電荷中心重疊屬于非極性分子,
A.SO2 屬于V形分子,正負(fù)電荷中心不重疊屬于極性分子;
B.CS2 屬于直線形分子,正負(fù)電荷中心重疊屬于非極性分子;
C.BF3 屬于平面三角形分子,正負(fù)電荷中心重疊屬于非極性分子;
D.PCl3屬于三角錐形分子,正負(fù)電荷中心不重疊屬于極性分子;
所以與羰基鐵分子的極性相似的分子是B、C;
故答案為:B、C;
(3)水分子中氧原子存在孤對(duì)電子和成鍵電子對(duì),甲烷分子中不存在孤對(duì)電子,孤對(duì)電子產(chǎn)生排斥作用強(qiáng)于成對(duì)電子,使水分子中O-H鍵的鍵角減小,所以CH4分子中的鍵角大于H2O分子的鍵角;
故答案為:>;水分子中氧原子存在孤對(duì)電子和成鍵電子對(duì),甲烷分子中不存在孤對(duì)電子,孤對(duì)電子產(chǎn)生排斥作用強(qiáng)于成對(duì)電子;
(4)①血紅素分子間存在范德華力,分子中含有羧基能形成氫鍵,所以血紅素分子間存在的作用力包含范德華力和氫鍵;
故答案為:范德華力和氫鍵;
②2和4N原子只形成2個(gè)共價(jià)鍵,所以與Fe形成一般的共價(jià)鍵,使N原子形成8電子穩(wěn)定結(jié)構(gòu),1和3N形成3個(gè)共價(jià)鍵,已經(jīng)達(dá)到8電子穩(wěn)定結(jié)構(gòu),不能再形成共用電子對(duì),但是含有孤電子對(duì),能形成配位鍵;
故答案為:1和3.
點(diǎn)評(píng) 本題主要考查了基態(tài)原子的核外電子排布、共價(jià)鍵的類(lèi)型、分子的極性、鍵角、氫鍵、配位鍵等知識(shí),難度中等,側(cè)重于考查學(xué)生對(duì)基礎(chǔ)知識(shí)的綜合應(yīng)用能力,注意把握配位鍵形成的原理以及分子極性的判斷方法.


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 酯化反應(yīng)、硝化反應(yīng)以及酯的水解均屬于取代反應(yīng)類(lèi)型 | |
| B. | 乙醇生成溴乙烷和乙烯生成溴乙烷的反應(yīng)類(lèi)型相同 | |
| C. | 可用氫氧化鈉溶液除去乙酸乙酯中混有的乙酸和乙醇 | |
| D. | 甲烷、苯都屬于烴,都不存在同分異構(gòu)體 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | CH2=CH2+HCl$→_{△}^{催化劑}$CH3CH2Cl | |
| B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| C. | 2CH3CHO+O2$→_{△}^{催化劑}$2CH3COOH | |
| D. | CH3CH2Br+NaOH$\stackrel{乙醇}{→}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:多選題
| A. | 在侯氏制堿工業(yè)中,向飽和氯化鈉溶液中先通二氧化碳,后通氨氣 | |
| B. | 在硫酸工業(yè)、合成氨工業(yè)、硝酸工業(yè)中,皆采用循環(huán)操作提高原料利用率 | |
| C. | 在氯堿工業(yè),電解槽一般用鐵網(wǎng)作電極 | |
| D. | 合成氨工業(yè)用天然氣造氣的方法中,與水蒸汽高溫反應(yīng)優(yōu)于熱分解法 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物質(zhì)的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
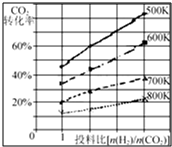 在一定條件下,將燃煤廢氣中的CO2轉(zhuǎn)化為二甲醚的反應(yīng)為:
在一定條件下,將燃煤廢氣中的CO2轉(zhuǎn)化為二甲醚的反應(yīng)為:| 時(shí)間(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 壓強(qiáng)比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題

查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com