
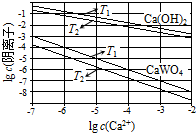
 已知氫氧化鈣和鎢酸鈣(CaWO4)都是微溶電解質,兩者的溶解度均隨溫度升高而減小.在鎢冶煉工藝中,將氫氧化鈣加入鎢酸鈉堿性溶液中得到鎢酸鈣,發生反應
已知氫氧化鈣和鎢酸鈣(CaWO4)都是微溶電解質,兩者的溶解度均隨溫度升高而減小.在鎢冶煉工藝中,將氫氧化鈣加入鎢酸鈉堿性溶液中得到鎢酸鈣,發生反應| 溫度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
分析 (1)①T1時KSP(CaWO4)=c(Ca2+)•c(WO42-),根據表中該溫度下離子的濃度代入計算;
②沉淀的溶解平衡是吸熱的過程,溫度高,溶度積常數大;
(2)①反應平衡常數K等于生成物平衡濃度系數次方之積和反應物平衡濃度系數次方之積;
②對于吸熱反應,溫度高,K越大,反之越低;
(3)根據濃度對反應平衡移動的影響:增大產物濃度,平衡逆向移動來回答.
解答 解:(1)①T1時KSP(CaWO4)=c(Ca2+)•c(WO42-)=1×10-5×1×10-5=1×10-10,故答案為:1×10-10;
②沉淀的溶解平衡是吸熱的過程,溫度高,溶度積常數大,根據表中數據,可以看出下的Ksp較大,所以T1<T2,故答案為:<;
(2)①反應平衡常數K等于生成物平衡濃度系數次方之積和反應物平衡濃度系數次方之積,即K=$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$,故答案為:$\frac{{c}^{2}(O{H}^{-})}{c(W{{O}_{4}}^{2-})}$;
②根據表中溫度和K之間的關系,可以看出溫度高,K越大,所以反應是吸熱的,故答案為:>;
(3)常溫下向較濃AlCl3的溶液中不斷通入HCl氣體,可析出大量AlCl3•6H2O晶體,原因是AlCl3飽和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl氣體,溶液中c(Cl-)增大,平衡向析出氯化鋁固體的方向移動,則可析出晶體,
故答案為:AlCl3飽和溶液中存在溶解平衡:AlCl3•6H2O(s)═Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl氣體使溶液中c(Cl-)增大,平衡向析出固體的方向移動從而析出AlCl3•6H2O晶體.
點評 本題考查學生化學平衡常數的有關計算、影響平衡移動的因素、沉淀溶解平衡等方面的知識,為高頻考點,側重于學生的分析、計算能力的考查,題目較為綜合,難度中等,注意把握平衡常數的意義,學會分析圖象.


科目:高中化學 來源: 題型:推斷題
 周期表前四周期的元素A、B、C、D、E,原子序數依次增大.A的核外電子總數與其周期數相同,B的價電子層中未成對電子有3個,C的最外層電子數為其內層電子數的3倍,D與C同族;E的最外層只有1個電子,但次外層有18個電子.回答下列問題;
周期表前四周期的元素A、B、C、D、E,原子序數依次增大.A的核外電子總數與其周期數相同,B的價電子層中未成對電子有3個,C的最外層電子數為其內層電子數的3倍,D與C同族;E的最外層只有1個電子,但次外層有18個電子.回答下列問題;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
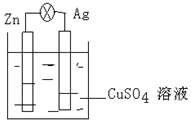 (1)在銀鋅原電池中,以硫酸銅為電解質溶液,鋅為負極,該電極上發生的電極反應式為Zn-2e-=Zn2+,銀電極上發生的是還原反應(“氧化”或“還原”).
(1)在銀鋅原電池中,以硫酸銅為電解質溶液,鋅為負極,該電極上發生的電極反應式為Zn-2e-=Zn2+,銀電極上發生的是還原反應(“氧化”或“還原”). .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知A(g)+B(g)?C(g)+D(s)反應的平衡常數與溫度的關系如下:
已知A(g)+B(g)?C(g)+D(s)反應的平衡常數與溫度的關系如下:| 溫度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常數 | 1.0 | 10.0 | 12.5 | 16.1 | 17.7 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 方法Ⅰ | 用炭粉在高溫條件下還原CuO |
| 方法Ⅱ | 電解法,反應為2Cu+H2O$\frac{\underline{\;電解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)還原新制Cu(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
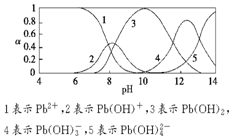 水體中重金屬鉛的污染問題備受關注.水溶液中鉛的存在形態主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形態的濃度分數α隨溶液pH變化的關系如圖所示.
水體中重金屬鉛的污染問題備受關注.水溶液中鉛的存在形態主要有Pb2+、Pb(OH)+、Pb(OH)2(微溶)、Pb(OH)3-、Pb(OH)42-,各形態的濃度分數α隨溶液pH變化的關系如圖所示.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com