
(8分)(1)49 g硫酸的物質的量為 mol,若在水中完全電離可產生 molH+ , ______mol.若有一定量的硫酸完全電離產生
個
,此硫酸的質量為 _______g.
(2)標準狀況下,11.2L的H2S氣體質量為17g,則H2S的摩爾質量是 ,相對分子質量為 ; 等物質的量的NH3與H2S質量比為 ; 1.7g氨氣與 mol H2O含有的電子數相等。
 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源:2013屆湖北省武漢市四校高三10月聯考化學試卷(帶解析) 題型:填空題
(8分)中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“減碳”的手段之一是節能,下列制氫方法最節能的是
A.電解水制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高溫使水分解制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太陽光催化分解水制氫:2H2O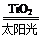 2H2↑+O2↑
2H2↑+O2↑
D.天然氣制氫:CH4+H2O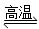 CO+3H2
CO+3H2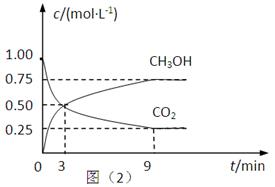
(2)CO2可轉化成有機物實現碳循環。在體積為1L的密閉容器中,充入1mol CO2和3mol H2,一定條件下反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化如上圖所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化如上圖所示。
①從3 min到9 min,v(H2)=________mol·L-1·min-1。
②能說明上述反應達到平衡狀態的是____________(填編號)。
A.反應中CO2與CH3OH的物質的量濃度之比為1∶1(即圖中交叉點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3mol H2,同時生成1mol H2O
D.CO2的體積分數在混合氣體中保持不變
(3)工業上,CH3OH也可由CO和H2合成。參考合成反應CO(g)+2H2(g) CH3OH(g)的平衡常數:
CH3OH(g)的平衡常數:
| 溫度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化學 來源:2012屆上海市普陀區高三4月質量調研(二模)化學試卷(帶解析) 題型:填空題
(本題共8分)將2molCO2和6molH2充入容積為3L的密閉容器中,在一定溫度和壓強條件下發生了下列反應:CO2(g)+3H2 (g) CH3OH(g)+H2O(g) +49.0 kJ。反應在2分鐘時達到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反應在2分鐘時達到了平衡。
(1).用H2與CO2濃度的變化表示該反應的速率,以它們的速率表示反應達到平衡的關系式是_____________________。
(2).當改變反應的某一個條件,平衡一定向正反應方向移動的是__________。
a.逆反應速率先增大后減少 b.正反應速率先增大后減少
c.某反應物的體積百分含量減小 d.化學平衡常數K值增大
(3).達到平衡時,改變溫度(T)和壓強(P),反應混合物中CH3OH的“物質的量分數”變化情況如圖所示,關于溫度(T)和壓強(P)的關系判斷正確的是 (填序號)。
| A.P3>P2T3>T2 | B.P2>P4T4>T2 |
| C.P1>P3T1>T3 | D.P1>P4T2>T3 |
查看答案和解析>>
科目:高中化學 來源:2012-2013學年湖北省武漢市四校高三10月聯考化學試卷(解析版) 題型:填空題
(8分)中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“減碳”的手段之一是節能,下列制氫方法最節能的是
A.電解水制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高溫使水分解制氫:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太陽光催化分解水制氫:2H2O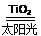 2H2↑+O2↑
2H2↑+O2↑
D.天然氣制氫:CH4+H2O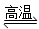 CO+3H2
CO+3H2
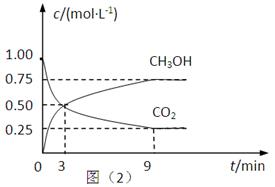
(2)CO2可轉化成有機物實現碳循環。在體積為1L的密閉容器中,充入1mol CO2和3mol H2,一定條件下反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化如上圖所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化如上圖所示。
①從3 min到9 min,v(H2)=________mol·L-1·min-1。
②能說明上述反應達到平衡狀態的是____________(填編號)。
A.反應中CO2與CH3OH的物質的量濃度之比為1∶1(即圖中交叉點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3mol H2,同時生成1mol H2O
D.CO2的體積分數在混合氣體中保持不變
(3)工業上,CH3OH也可由CO和H2合成。參考合成反應CO(g)+2H2(g) CH3OH(g)的平衡常數:
CH3OH(g)的平衡常數:
|
溫度/℃ |
0 |
100 |
200 |
300 |
400 |
|
平衡常數 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
下列說法正確的是_____。
A.該反應正反應是放熱反應
B.該反應在低溫下不能自發進行,高溫下可自發進行,說明該反應△S<0
C.在T℃時,1L密閉容器中,投入0.1mol CO和0.2 mol H2,達到平衡時,CO轉化率為50%,則此時的平衡常數為100
D.工業上采用稍高的壓強(5Mpa)和250℃,是因為此條件下,原料氣轉化率最高
查看答案和解析>>
科目:高中化學 來源:2011-2012學年上海市普陀區高三4月質量調研(二模)化學試卷(解析版) 題型:填空題
(本題共8分)將2molCO2和6molH2充入容積為3L的密閉容器中,在一定溫度和壓強條件下發生了下列反應:CO2(g)+3H2
(g) CH3OH(g)+H2O(g)
+49.0 kJ。反應在2分鐘時達到了平衡。
CH3OH(g)+H2O(g)
+49.0 kJ。反應在2分鐘時達到了平衡。
(1).用H2與CO2濃度的變化表示該反應的速率,以它們的速率表示反應達到平衡的關系式是_____________________。
(2).當改變反應的某一個條件,平衡一定向正反應方向移動的是__________。
a.逆反應速率先增大后減少 b.正反應速率先增大后減少
c.某反應物的體積百分含量減小 d.化學平衡常數K值增大
(3).達到平衡時,改變溫度(T)和壓強(P),反應混合物中CH3OH的“物質的量分數”變化情況如圖所示,關于溫度(T)和壓強(P)的關系判斷正確的是 (填序號)。

A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3 D.P1>P4 T2>T3
(4).平衡時,測得H2O(g)的物質的量分數為0.30,則用H2O(g)的物質的量濃度變化來表示該反應在2分鐘內的平均反應速率為 mol ∙ L-1∙ min-1。
查看答案和解析>>
科目:高中化學 來源:2013屆黑龍江七校高一期末聯考化學試卷 題型:填空題
(8分)(1)49 g硫酸的物質的量為
mol,若在水中完全電離可產生 molH+ ,
______mol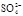 .若有一定量的硫酸完全電離產生
.若有一定量的硫酸完全電離產生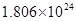 個
個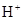 ,此硫酸的質量為
_______g.
,此硫酸的質量為
_______g.
(2)標準狀況下,11.2L的H2S氣體質量為17g,則H2S的摩爾質量是 ,相對分子質量為 ; 等物質的量的NH3與H2S質量比為 ; 1.7g氨氣與 mol H2O含有的電子數相等。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com