
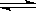 2NH3(正反應為放熱反應)下列敘述正確的是
2NH3(正反應為放熱反應)下列敘述正確的是| A.反應物和生成物的濃度相等 | B.N2和H2的濃度之比一定為1:3 |
| C.降低溫度,平衡混合物里NH3的濃度增大 | D.增大壓強,不利于氨的合成 |
科目:高中化學 來源:不詳 題型:填空題
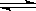 CO(g) + H2O(g) ;其平衡常數K和溫度t的關系如下:
CO(g) + H2O(g) ;其平衡常數K和溫度t的關系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
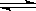 CO(g) + H2O(g),在該容器內各物質的濃度變化如下:
CO(g) + H2O(g),在該容器內各物質的濃度變化如下:| 時間/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
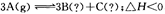 ,下列分析一定正確的是
,下列分析一定正確的是查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 。
。 )·c(H2)=c(CO)·c(H2O)。試判斷此時的溫度為_____________
)·c(H2)=c(CO)·c(H2O)。試判斷此時的溫度為_____________查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
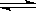 CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1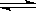 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1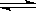 CO2(g)+H2(g)的焓變(△H)為 。
CO2(g)+H2(g)的焓變(△H)為 。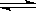 CH3OH(g)。甲醇是一種燃料,可用于設計燃料電池。下圖是甲醇燃料電池的原理示意圖。
CH3OH(g)。甲醇是一種燃料,可用于設計燃料電池。下圖是甲醇燃料電池的原理示意圖。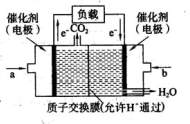 ①a處通入的是 (填物質名稱),左側電極上發
①a處通入的是 (填物質名稱),左側電極上發 CO2(g)+H2(g)△H=akJ·mol-1,得到下列數據:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列數據: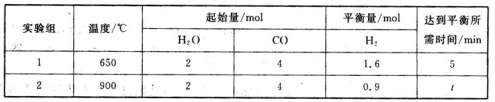
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 W+Z,反應速率(V)隨時間(t)變化的情況如圖所示。
W+Z,反應速率(V)隨時間(t)變化的情況如圖所示。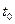 表示在其他條件不變的情況下,改變體系的一個條件(溫度、濃度、壓強)所引起的變化。則下列分析正確的是
表示在其他條件不變的情況下,改變體系的一個條件(溫度、濃度、壓強)所引起的變化。則下列分析正確的是
A.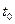 時條件改變引起的變化是平衡向正反應方向移動 時條件改變引起的變化是平衡向正反應方向移動 |
B.若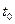 改變 改變 的條件是壓強,則W、Z均為氣體,X、Y中只有一種為氣體 的條件是壓強,則W、Z均為氣體,X、Y中只有一種為氣體 |
C.若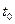 改變的條件是溫 改變的條件是溫 度,則該反應的正反應是吸熱反應 度,則該反應的正反應是吸熱反應 |
D.若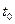 改變的條件是濃度,改變的方法是減小X、Y的濃度 改變的條件是濃度,改變的方法是減小X、Y的濃度 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 體混合于容積為2L的某密閉容器中,發生如下反應:3A(g)+ B(g)
體混合于容積為2L的某密閉容器中,發生如下反應:3A(g)+ B(g)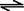 XC(g)+2D(g),2min末反應達到平衡狀態,生成0.8molD,并測得C的濃度為0.4mol/L,請填寫下列空白:
XC(g)+2D(g),2min末反應達到平衡狀態,生成0.8molD,并測得C的濃度為0.4mol/L,請填寫下列空白:
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
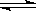 C(g)+2D(g)達到平衡后,升高溫度容器內氣體的密度增大,則下列敘述一定正確的是
C(g)+2D(g)達到平衡后,升高溫度容器內氣體的密度增大,則下列敘述一定正確的是| A.正反應是吸熱反應,且A不是氣態 |
| B.正反應是放熱反應,且A是氣態 |
| C.加入少量C,物質A的轉化率增大 |
| D.改變壓強對該平衡的移動無影響 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com