
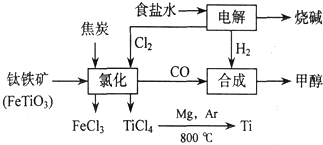
分析 由圖可知,電解飽和食鹽水生成NaOH、氫氣、氯氣,氫氣與CO合成甲醇,氯氣、C與鈦鐵礦發生氧化還原反應,Mg還原TiCl4得到Ti,
(1)電解食鹽水生成NaOH、H2和Cl2,以此書寫離子方程式;
(2)從圖示可知氯化時的反應物為FeTiO3、C、Cl2,生成物為FeCl3、TiCl4、CO,再根據得失電子和原子守恒即可得出該反應的方程式;
(3)A.1mol可燃物燃燒生成穩定氧化物放出的熱量為燃燒熱;
B.反應熱為反應物總能量與生成物總能量的差值;
C.物質的量與反應放出的熱量成正比;
D.由圖可知,轉化過程中存在有毒氣體的參與.
(4)根據CO+2H2→CH3OH、2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2TiCl4+2FeCl3+6CO、2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑可知CH3OH~CO~$\frac{7}{6}$Cl2~$\frac{7}{6}$H2,以此計算;
(5)堿性甲醇電池中,甲醇在負極上失電子發生氧化反應.
解答 解:由圖可知,電解飽和食鹽水生成NaOH、氫氣、氯氣,氫氣與CO合成甲醇,氯氣、C與鈦鐵礦發生氧化還原反應,Mg還原TiCl4得到Ti,
(1)電解食鹽水生成NaOH、H2和Cl2,反應的離子方程式為2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑,故答案為:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑;
(2)從圖示可知氯化時的反應物為FeTiO3、C、Cl2,生成物為FeCl3、TiCl4、CO,再根據得失電子和原子守恒即可得出該反應的方程式為2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2TiCl4+2FeCl3+6CO,
故答案為:2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2TiCl4+2FeCl3+6CO;
(3)A.Mg不是在O2中燃燒,故641kJ/mol不能稱其燃燒熱,故A錯誤;
B.反應Ti(s)+2Cl2(g)=TiCl4(s)為放熱反應,1mol Ti(s)和2mol Cl2 (g)的總能量大于1mol TiCl4 (s)的總能量,故B錯誤;
C.假設質量均為24g,則Mg(s)與足量Cl2(g)反應放出641kJ熱量,24gTi(s) 與足量Cl2(g)反應放出的熱量=$\frac{24g}{48g/mol}$×770kJ=385kJ,故C正確;
D.該冶煉Ti法,氯氣、CO等均看污染環境,不符合對環境友好,故D錯誤;
故答案為:C;
(4)根據CO+2H2→CH3OH、2FeTiO3+6C+7Cl2$\frac{\underline{\;高溫\;}}{\;}$2TiCl4+2FeCl3+6CO、2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑可知,CH3OH~CO~$\frac{7}{6}$Cl2~$\frac{7}{6}$H2,所以生產1 molCH3OH,理論上還需補充氫氣(2-$\frac{7}{6}$)mol=$\frac{5}{6}$mol,即$\frac{5}{3}$gH2,故生產192 t CH3OH還需補充H2的質量為$\frac{192}{32}$×$\frac{5}{3}$=10t,
故答案為:10;
(5)堿性甲醇電池中,負極上甲醇失電子和氫氧根離子反應生成碳酸根離子和水,電極反應式為CH3OH-6e-+8OH-=CO32-+6H2O,故答案為:CH3OH-6e-+8OH-=CO32-+6H2O.
點評 本題考查較為綜合,側重物質制備及分離提純的綜合考查,為高頻考點,涉及離子方程式、化學反應與能量、電化學等知識,題目難度中等,(4)中關系式法計算為解答的難點.


科目:高中化學 來源: 題型:選擇題
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
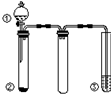 利用如圖所示裝置進行下列實驗,能得出相應實驗結論的是( )
利用如圖所示裝置進行下列實驗,能得出相應實驗結論的是( )| 選項 | ① | ② | ③ | 實驗結論 |
| A | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金屬性:S>C>Si |
| B | 稀硝酸 | Na2S | AgNO3與AgCl的濁液 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 濃鹽酸 | MnO2 | NaOH溶液 | 氧化性:MnO2>Cl2 |
| D | 濃硫酸 | 蔗糖 | 酸性KMnO4溶液 | 濃硫酸具有酸性、脫水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
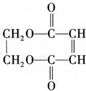 )可用于生產合成樹脂、合成橡膠等.以丙烯為原料制備環酯J的合成路線如圖:
)可用于生產合成樹脂、合成橡膠等.以丙烯為原料制備環酯J的合成路線如圖: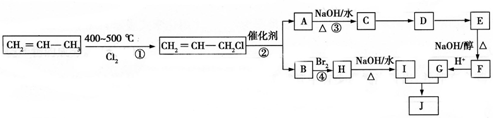
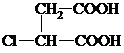 ,G分子中含有的官能團是羧基和碳碳雙鍵(填官能團名稱).
,G分子中含有的官能團是羧基和碳碳雙鍵(填官能團名稱).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在蒸餾水中加入大量NaOH固體,KW不變 | |
| B. | 0.1mol/LHF溶液的PH=2,則該溶液中c(OH-)>c(HF) | |
| C. | 在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) | |
| D. | NaCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 往1.0mol•L-1KI溶液中加入固體I2,發生反應:I2(aq)+I- (aq)═I3-(aq)△H;I-的物質的量濃度c(I-)隨溫度T的變化曲線如圖所示.已知反應第一次達到平衡時用時10s,則下列說法正確的是( )
往1.0mol•L-1KI溶液中加入固體I2,發生反應:I2(aq)+I- (aq)═I3-(aq)△H;I-的物質的量濃度c(I-)隨溫度T的變化曲線如圖所示.已知反應第一次達到平衡時用時10s,則下列說法正確的是( )| A. | 該反應的△H>0 | |
| B. | a、c兩點對應的I-反應速率相等 | |
| C. | b點時0~10s I-的平均反應速率為0.04mol•L-1•s-1 | |
| D. | d點時該反應在對應溫度下處于平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 反應2Mg(s)+CO2(g)═2MgO(s)+C(s)能自發進行,則該反應的△H<0 | |
| B. | 鉛蓄電池放電時反應為:PbO2+Pb+2H2SO4═2PbSO4+H2O,正、負極質量均減小 | |
| C. | 常溫下,NH4Cl溶液加水稀釋,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不變 | |
| D. | 常溫下,向飽和Na2CO3溶液中加少量BaSO4粉末,充分攪拌后過濾,向洗凈的沉淀中加稀鹽酸,有氣泡產生,說明常溫下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ;其所含化學鍵類型為共價鍵、離子鍵;
;其所含化學鍵類型為共價鍵、離子鍵;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com