
【題目】在一定溫度下,將氣體X和Y各1.6mol充入10L恒容密閉容器中,發生如下反應:X(g)+ Y(g)![]() 2Z(g),在反應過程中,X的物質的量與時間的關系如下表所示:
2Z(g),在反應過程中,X的物質的量與時間的關系如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | …… | 16 | 18 |
n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | …… | …… | 1.000 | 1.000 |
請完成下列各題:
(1)4~6min時間段內Z的平均反應速率為 ;
(2)此溫度下該反應的平衡常數K= ;若升高溫度, K減小,則正反應 (填“吸熱”或“放熱”)反應
(3)若改變反應條件, Z的體積分數w(Z)的變化如圖,曲線(Ⅰ)所示的條件可能是 。(填入下列條件的序號)

①恒容條件下,升高溫度;
②恒容條件下,降低溫度;
③恒溫條件下,縮小反應容器體積;
④恒溫條件下,擴大反應容器體積;
⑤恒溫恒容條件下,加入適當催化劑。
(4)若保持其他條件不變,再充入1.6mol Z,達新平衡后Z的體積分數為_ __(保留一位小數)
【答案】(1)2.5×10-3mol/(L·min);(2)K=1.44 ;放熱;(3)③⑤;(4)37.5%
【解析】
試題分析:(1)分析表中數據知4~6min時間段內X的物質的量變化為(1.100-1.075)mol=0.025mol,根據反應:X(g)+ Y(g)![]() 2Z(g)知Z的物質的量變化為0.05mol,容器的體積為10L,Z的物質的量濃度變化為0.005mol/L,Z的平均反應速率為0.005mol/L÷2min=2.5×10-3mol/(L·min)。
2Z(g)知Z的物質的量變化為0.05mol,容器的體積為10L,Z的物質的量濃度變化為0.005mol/L,Z的平均反應速率為0.005mol/L÷2min=2.5×10-3mol/(L·min)。
(2)分析表中數據知反應達平衡時n(X)=1.000mol,根據反應X(g)+ Y(g)![]() 2Z(g)知n(Y)=1.000mol,n(Z)=1.200mol,則c(X)=0.1000mol/L,c(Y)=0.1000mol/L,c(Z)=0.1200mol/L,此溫度下該反應的平衡常數K= c2(Z)/ c(X) c(Y)=1.44;若升高溫度, K減小,平衡逆向移動,升高溫度平衡向吸熱反應方向移動,則正反應放熱反應。
2Z(g)知n(Y)=1.000mol,n(Z)=1.200mol,則c(X)=0.1000mol/L,c(Y)=0.1000mol/L,c(Z)=0.1200mol/L,此溫度下該反應的平衡常數K= c2(Z)/ c(X) c(Y)=1.44;若升高溫度, K減小,平衡逆向移動,升高溫度平衡向吸熱反應方向移動,則正反應放熱反應。
(3)根據圖像知改變反應條件, 由曲線II變為I,Z的體積分數w(Z)不變,平衡不移動,達平衡的時間縮短,反應速率加快。①恒容條件下,升高溫度,平衡向吸熱反應方向移動,錯誤;②恒容條件下,降低溫度,平衡向放熱反應方向移動,錯誤;③恒溫條件下,縮小反應容器體積,壓強增大,反應速率加快,該反應為反應前后氣體物質的量不變的反應,增大壓強,平衡不移動,Z的體積分數不變,正確;④恒溫條件下,擴大反應容器體積,壓強減小,反應速率減慢,錯誤;⑤恒溫恒容條件下,加入適當催化劑,反應速率加快,平衡不移動,Z的體積分數不變,正確,選③⑤。
(4)若保持其他條件不變,再充入1.6mol Z,相當于增大壓強,該反應為反應前后氣體物質的量不變的反應,增大壓強,平衡不移動,達新平衡后Z的體積分數不變,由表中數據計算Z的體積分數。分析表中數據知反應達平衡時n(X)=1.000mol,根據反應X(g)+ Y(g)![]() 2Z(g)知n(Y)=1.000mol,n(Z)=1.200mol,Z的體積分數為1.200mol÷(1+1+1.2)mol=37.5%。
2Z(g)知n(Y)=1.000mol,n(Z)=1.200mol,Z的體積分數為1.200mol÷(1+1+1.2)mol=37.5%。


 一卷搞定系列答案
一卷搞定系列答案 名校作業本系列答案
名校作業本系列答案 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:
【題目】今有七種物質:①鋁線 ②熔化的KNO3 ③氯氣 ④NaCl 晶體⑤液態氯化氫 ⑥石灰水 ⑦乙醇
(1)其中能導電的物質是
(2)屬于電解質的是
(3)屬于非電解質的是 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將一定質量的銅片加入到20 mL某濃度的濃硝酸中,充分反應后,銅片全部溶解,并收集到標準狀況下的混合氣體共896mL(假設氣體中只有NO和NO2)。向反應后所得溶液中逐滴滴加1mol/L的NaOH溶液,產生沉淀質量與加入Na0H溶液體積(單位:mL)的關系如圖所示。回答下列問題:

(1)B點所表示溶液中只含一種溶質,該物質是_______(填化學式)。
(2)收集的氣體中,NO2的物質的量為______mol。
(3)銅片的質量為______g。
(4)原濃硝酸的濃度為________________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F、G為原子序數依次增大的短周期主族元素。B、C、D均能與A形成10電子分子,E單質可用于焊接鋼軌,F與D同主族,F與G同周期。
(1)F的離子結構示意圖為___________。
(2)D、E、F的離子半徑由大到小的順序為__________________(填離子符號)。
(3)寫出能證明G比F非金屬性強的一個化學方程式______________________。
(4)F和G的一種化合物甲中所有原子均為8電子穩定結構,該化合物與水反應生成F單質、F的最高價含氧酸和G的氫化物,三種產物的物質的量之比為2:1:6,甲的電子式為_________,該反應的化學方程式為__________________。
(5)C能分別與A和D按原子個數比1:2形成化合物乙和丙,乙的結構式為_________________。常溫下,液體乙與氣體丙反應生成兩種無污染的物質,若共生成1mol產物時放熱QkJ,該反應的熱化學方程式為__________________。
(6)現取100mL 1mol/L的E的氯化物溶液,向其中加入1mol/L氫氧化鈉溶液產生了3.9g沉淀,則加入的氫氧化鈉溶液體積可能為________________mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L密閉容器內,800 ℃時反應2NO(g)+O2(g) 2NO2(g)體系中,n(NO)隨時間的變化如表所示:
時間/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)在第5 s時,NO的轉化率為________。
(2)如圖中表示NO2變化曲線的是______。
用O2表示0~2 s內該反應的平均速答題率v=_______。

(3)能說明該反應已達到平衡狀態的是________。
a.v(NO2)=2v(O2) b.容器內壓強保持不變
c.v逆(NO)=2v正(O2) d.容器內密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中每種物質都既有離子鍵又有共價鍵的一組是( )。
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、HNO3
C.Ba(OH)2、Na2CO3、Na3PO4
D.HCl、Al2O3、MgCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于化學鍵的有關說法中正確的是( )。
A.化學鍵存在于原子之間,也存在于分子之間
B.兩個原子之間的相互作用叫作化學鍵
C.離子鍵是陰、陽離子之間的相互吸引力
D.化學鍵通常指相鄰原子之間強烈的相互作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁、戊五種物質中,甲、乙、丙中均含有某種相同的元素,它們之間具有如圖所示轉化關系(反應條件及部分產物己略去)。下列有關物質的推斷不正確的是
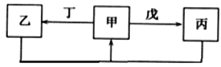
A. 若甲為Al(OH)3,則戊可能為NaOH B. 若甲為Na2CO3,則丁可能為CO2
C. 若甲為N2,則丁可能為O2 D. 若甲為Fe, 則戊可能為鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電鍍廠曾采用有氰電鍍工藝,處理有氰電鍍的廢水時,可在催化劑TiO2作用下,先用NaClO將CN-離子氧化成CNO-,在酸性條件下CNO-繼續被NaClO氧化成N2和CO2。環保工作人員在密閉系統中用下圖裝置進行實驗,以證明處理方法的有效性,并通過測定二氧化碳的量確定CN-被處理的百分率。
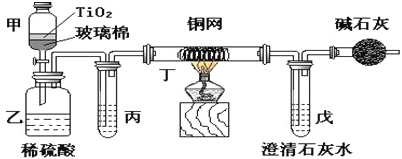
將濃縮后含CN-離子的污水與過量NaClO溶液的混合液共200 mL(其中CN-的濃度為0.05 molL-1倒入甲中,塞上橡皮塞,一段時間后,打開橡皮塞和活塞,使溶液全部放入乙中,關閉活塞。回答下列問題:
(1)甲中反應的離子方程式為________________________,乙中反應的離子方程式為________________________。
(2)乙中生成的氣體除N2和CO2外,還有HCl及副產物Cl2等。丙中加入的除雜試劑是飽和食鹽水,其作用是_____________________,丁在實驗中的作用是______________,裝有堿石灰的干燥管的作用是______________________________。
(3)戊中盛有含Ca(OH)20.02mol的石灰水,若實驗中戊中共生成0.82 g沉淀,則該實驗中測得CN-被處理的百分率等于__________。該測得值與工業實際處理的百分率相比總是偏低,簡要說明可能原因之一_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com