
| A. | 其他條件不變時增大壓強,能使全氣體反應體系中活化分子百分數增加 | |
| B. | 中和反應都是放熱反應 | |
| C. | 在FeCl3溶液和KSCN溶液反應的平衡體系中,加入KCl固體,平衡逆向移動 | |
| D. | 熵增大的反應不一定自發,但自發反應熵定增大 |
分析 A、增大氣體反應體系的壓強,活化分子百分數不變;
B、中和反應都是放熱反應;
C、根據實際參加反應的離子濃度分析,加入少量KCl固體,溶液中Fe3+、SCN-濃度不變;
D、依據△H-T△S<0反應自發進行,△H-T△S>0屬于非自發進行分析.
解答 解:A、增大氣體反應體系的壓強,體積減小,則反應物濃度增大,單位體積中活化分子數增多,但活化分子百分數不變,故A錯誤;
B、中和反應都是放熱反應,故B正確;
C、根據實際參加反應的離子濃度分析,化學平衡為Fe3++3SCN-=Fe(SCN)3,加入少量KCl固體,溶液中Fe3+、SCN-濃度不變,溶液顏色不變,故C錯誤;
D、依據△H-T△S<0反應自發進行,△H-T△S>0屬于非自發進行分析,熵增大反應△S>0,△H>0低溫下反應自發進行,△S<0,△H<0,低溫下反應自發進行,自發反應熵不一定增大,故D錯誤;
故選B.
點評 本題考查了壓強對活化分子的影響,平衡移動以及反應自發進行的判斷依據和分析方法,掌握基礎是關鍵,題目較簡單.


科目:高中化學 來源: 題型:選擇題
| A. | 物質發生化學反應時都伴隨著能量變化,伴隨能量變化的變化一定是化學變化 | |
| B. | 需要加熱的化學反應一定是吸熱反應,不需要加熱就能進行的反應一定是放熱反應 | |
| C. | 等質量的硫蒸氣和硫固體分別完全燃燒,前者放出的熱量多 | |
| D. | 因為3O2═2O3是吸熱反應,所以臭氧比氧氣更穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

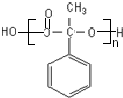 ;
;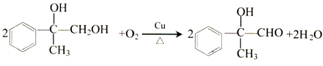 ,
,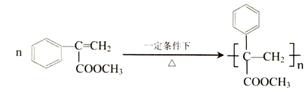 ;
;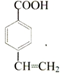 (寫結構簡式).
(寫結構簡式).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
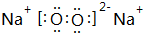 ,Z的化學式SiO2;
,Z的化學式SiO2;查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | “即熱飯盒”的工作原理是將化學能轉化為熱能 | |
| B. | 上述反應中,反應物的總焓大于生成物的總焓 | |
| C. | 鐵粉的作用是催化劑 | |
| D. | 上述反應的反應熱Q為正值 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知:A是來自石油的重要有機化工原料,E是具有果香味的有機物,F是一種高聚物,可制成食品包裝材料.
已知:A是來自石油的重要有機化工原料,E是具有果香味的有機物,F是一種高聚物,可制成食品包裝材料.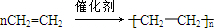 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4.5mol•L-1 | B. | 5mol•L-1 | C. | 6mol•L-1 | D. | 8mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com