
【題目】銅及其化合物在工業生產及生活中用途非常廣泛。回答下列問題:
(1)硫酸銅溶液呈藍色,是因為其中含有[Cu(H2O)4]2+,該離子的結構簡式為______(標出配位鍵,不考慮空間構型)。向硫酸銅溶液中滴加氨水會生成藍色沉淀,再滴加氨水至沉淀剛全部溶解時可得到藍色的[Cu(NH3)4SO4溶液,繼續向其中加入乙醇會有藍色晶體析出,原因是_______。
(2)新制Cu(OH)2懸濁液可將乙醛(CH3CHO)氧化成乙酸,而自身還原成Cu2O。乙酸的沸點高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合銅(I)]是有機合成中常見催化劑。該配合物中與中心Cu形成配位健的原子_________。BF4-的空間構型為_____,與其互為等電子體的分子是_____________。
(4)已知:硫酸銅溶液中滴入氨基乙酸鈉(H2NCH2COONa)即可得到配合物A。其結構如圖所示。

①1mol氨基乙酸鈉(H2NCH2COONa)含有σ鍵的數目為_______。
②標出配合物A中的配位鍵________。
【答案】  乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子間氫鍵,而乙醛不能 N 正四面體型 CCl4 8NA
乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子間氫鍵,而乙醛不能 N 正四面體型 CCl4 8NA 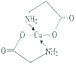 或
或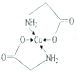
【解析】(1)考查配位鍵,Cu2+提供空軌道,H2O中O提供孤電子對,因此該離子的結構簡式為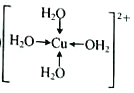 ;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氫鍵的形成條件,乙酸符合形成分子間氫鍵的條件,而乙醛不符合,因此乙酸能形成分子間氫鍵,而乙醛不能,因此乙酸的沸點比乙醛高;(3)考查配位鍵、空間構型、等電子體的判斷,CH3CN中只有N有孤電子對,因此提供孤電子對的是N,即N與Cu形成配位鍵;BF4-中B含有4個σ鍵,孤電子對(3+1-4×1)/2=0,價層電子對數為4,空間構型為正四面體;與其互為等電子體的分子式為CCl4等;(4)考查化學鍵數目的判斷。配位鍵的表示,①此化合物為離子化合物,是由H2NCH2COO-和Na+組成,1molH2NCH2COO-中含有σ鍵的數目是8NA;②Cu提供空軌道,O最外層6個電子,形成2個化學鍵,N最外層5個電子,形成三個共價鍵,達到穩定結構,根據化合物A的結構圖,Cu和N形成配位鍵,即
;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氫鍵的形成條件,乙酸符合形成分子間氫鍵的條件,而乙醛不符合,因此乙酸能形成分子間氫鍵,而乙醛不能,因此乙酸的沸點比乙醛高;(3)考查配位鍵、空間構型、等電子體的判斷,CH3CN中只有N有孤電子對,因此提供孤電子對的是N,即N與Cu形成配位鍵;BF4-中B含有4個σ鍵,孤電子對(3+1-4×1)/2=0,價層電子對數為4,空間構型為正四面體;與其互為等電子體的分子式為CCl4等;(4)考查化學鍵數目的判斷。配位鍵的表示,①此化合物為離子化合物,是由H2NCH2COO-和Na+組成,1molH2NCH2COO-中含有σ鍵的數目是8NA;②Cu提供空軌道,O最外層6個電子,形成2個化學鍵,N最外層5個電子,形成三個共價鍵,達到穩定結構,根據化合物A的結構圖,Cu和N形成配位鍵,即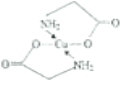 ,Cu配位數為4,因此還可以是
,Cu配位數為4,因此還可以是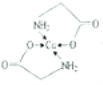 。
。


科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 非金屬元素形成的離子一定是陰離子
B. 非金屬單質在氧化還原反應中一定是氧化劑
C. 某元素從化合態變為游離態時,一定被還原
D. 金屬陽離子被還原不一定得到金屬單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.5mol/L的硫酸溶液480mL,根據溶液的配制情況回答下列問題。
(1)在下圖所示儀器中,配制上述溶液肯定不需要的是_________(填序號),除圖中已有儀器外,配制上述溶液還需要的玻璃儀器是 ___________________________。
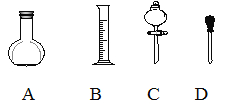
(2)根據計算得知,需用量筒量取質量分數為98%、密度為1.84g/cm3的濃硫酸的體積為__mL,如果實驗室有15mL、20mL、50mL量筒,應選用______ mL量筒最好。
(3)在容量瓶的使用方法中,下列操作不正確的是____________。
A、使用容量瓶前檢驗是否漏水
B、容量瓶用水洗凈后,再用待配溶液洗滌
C、配制溶液時,如果試樣是固體,把稱好的固體用紙條小心倒入容量瓶中,緩慢加水至接近刻度線1—2cm處,用膠頭滴管加蒸餾水至刻度線。
D、配制溶液時,若試樣是液體,用量筒取樣后用玻璃棒引流倒入容量瓶中,緩慢加水至刻度線1~2cm處,用膠頭滴管加蒸餾水至刻度線。
E、蓋好瓶塞,用食指頂住瓶塞,另一只手托住瓶底,把容量瓶反復倒轉多次,搖勻。
(4)在實驗中其他操作均正確,若定容時仰視刻度線,則所得溶液濃度______0.5mol/L(填“大于”“小于”或“等于”)。
(5)該同學在定容后,加蓋倒轉搖勻后,發現液面低于刻度線,又滴加蒸餾水至刻度。對所配溶液濃度的影響__________(填“偏高”、“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z、W原子序數依次增大。X氫化物的水溶液顯堿性;Y在元素周期表中所處的周期序數與族序數相等;Z單質是將太陽能轉化為電能的常用材料;W是重要的“成鹽元素”,主要以鈉鹽的形式存在于海水中。請回答:
(l)Y在元素周期表中的位置是__________;X氫化物的電子式是__________。
(2)X氫化物的水溶液與W氫化物的水溶液混合后恰好反應時,溶液呈__________(填“酸”、“堿”或“中”)性,用離子方程式表示其原因是__________。
(3)Y-AgO電池是應用廣泛的魚雷電池,其原理如下圖所示。
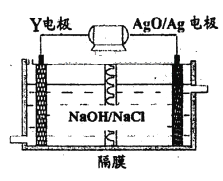
該電池的負極反應式是__________。
(4)Z和W比較,非金屬性較弱的是__________(填元素符號),下列可以驗證這一結論的是__________(填序號)。
a.元素在地殼中的含量
b.最高價氧化物對應水化物的酸性
c.斷開氫化物中1molH-Z或H-W鍵所需的能量
d.Z與W以共價鍵形成化合物時,Z或W顯示的電性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示的是A→E五種物質的相互轉化關系,其中A為淡黃色固體,B為單質,D為正鹽。

請回答下列問題:
(1)寫出各物質的名稱:
A_____________ ; C_____________;D_____________。
(2)寫出相應的離子方程式:
B→C: _____________________________;
C→D: ______________________________;
A→C: _____________________________;
D→E:_____________________________(任寫一個即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用鋅片與稀硫酸反應制取氫氣,下列措施不能使氫氣的生成速率增大的是( )
A. 加熱 B. 將鋅片改成鋅粉
C. 滴加少量CuSO4溶液 D. 加入適量Na2CO3粉末
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】周期表中前四周期的元素A、Z、Q、R、T的原子序數依次增大,且A、Z、Q同周期。A共有兩個原子軌道上有電子,且電子數目相同。Z、Q相鄰,且Z中的未成對電子數為3個,R元素在地殼中含量位于金屬元素的第二位。T是人類最早使用的元素,并以這種元素命名了我國的一個時代。請回答下面的問題:
(1)A、Z、Q第一電離能從小到大的順序為:_______________(填元素符號),T的價層電子排布圖為:__________________________。
(2)Q的基態原子中能量最高的電子,其電子云在空間有___________個方向,原子軌道呈_______形。
(3)Z3-的立體構型為____________,寫出與Z3-互為等電子體的一種非極性分子化學式____________。
(4)在不同的溫度下,A以ACl2和二聚體A2Cl4兩種形式存在,二聚體的結構式如圖所示:
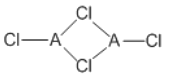
①ACl2中A的雜化方式為______________________。
②1mol A2Cl4中含配位鍵的數目為____________。
(5)R單質的晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。體心立方晶胞和面心立方晶胞的棱邊長分別為acm、bcm,則R單質的體心立方晶胞和面心立方晶胞的密度之比為_________,R原子配位數之比為_____________。
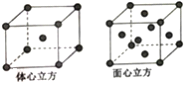
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物乙是一種治療神經類疾病的藥物,可由化合物甲經多步反應得到。下列有關甲、乙的說法正確的是
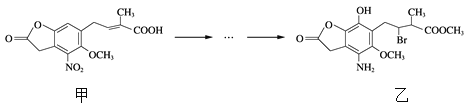
A. 甲的分子式為C14H14NO7
B. 甲、乙中各有1個手性碳原子
C. 可用NaHCO3溶液或FeCl3溶液鑒別化合物甲、乙
D. 乙能與鹽酸、NaOH溶液反應,且1 mol乙最多能與5 mol NaOH反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由A、B兩種金屬和稀硫酸組成的原電池,A是正極,則下列推斷正確的是( )
A.A電極上發生的電極反應是還原反應
B.A的金屬性強于B
C.電子不斷由A電極經外電路流向B電極
D.溶液中的陽離子移向負極
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com