
下列關于各實驗裝置圖的敘述中正確的是( )。

A.圖甲:除去Cl2中含有的少量HCl
B.圖乙:構成鋅—銅原電池
C.圖丙:根據實驗現象推知酸性CH3COOH>H2CO3>C6H5OH
D.圖丁:驗證溴乙烷發生消去反應生成烯烴
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第1講物質的組成性質和分類練習卷(解析版) 題型:選擇題
下列化學用語表示正確的是( )。
A.Cl-的結構示意圖:
B.甲烷分子的球棍模型:
C.氫氧化鈉的電子式: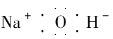
D.次氯酸的結構式:H—O—Cl
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習江蘇專用 第11講有機化學基礎練習卷(解析版) 題型:選擇題
阿司匹林是日常生活中應用廣泛的醫藥之一。它可由下列方法合成:

下列說法正確的是( )。
A.鄰羥基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化鄰羥基苯甲醛可實現反應①
C.反應②中加入適量的NaHCO3可提高阿司匹林的產率
D.與鄰羥基苯甲酸互為同分異構體,苯環上一氯代物僅有2種且能發生銀鏡反應的酚類化合物共有4種
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練專題12物質結構與性質(選修)練習卷(解析版) 題型:填空題
研究物質的微觀結構,有助于人們理解物質變化的本質。請回答下列問題:
(1)C、Si、N元素的電負性由大到小的順序是___________________,
C60和金剛石都是碳的同素異形體,二者相比,熔點高的是________,原因是____________________________。
(2)A、B均為短周期金屬元素,依據表中數據,寫出B的基態原子的電子排布式:________________。
電離能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
(3)過渡金屬離子與水分子形成的配合物是否有顏色,與其d軌道電子排布有關。一般地,d0或d10排布無顏色,d1~d9排布有顏色。如[Co(H2O)6]2+顯粉紅色。據此判斷:[Mn(H2O)6]2+________(填“無”或“有”)顏色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的結構式為 ,每個COCl2分子內含有________個σ鍵,________個π鍵,其中心原子采取________雜化軌道方式。
,每個COCl2分子內含有________個σ鍵,________個π鍵,其中心原子采取________雜化軌道方式。
②Fe(CO)5在一定條件下發生分解反應:Fe(CO)5(s)=Fe(s)+5CO(g)。反應過程中,斷裂的化學鍵只有配位鍵,則形成的化學鍵類型是________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練專題11實驗儀器使用及基本操作練習卷(解析版) 題型:實驗題
實驗室用硫酸銨、硫酸和廢鐵屑制備硫酸亞鐵銨晶體的方法如下:
步驟1:將廢鐵屑依次用熱的碳酸鈉溶液、蒸餾水洗滌。
步驟2:向盛有潔凈鐵屑的燒杯中加入稀H2SO4溶液,水浴加熱,使鐵屑與稀硫酸反應至基本不再冒出氣泡為止。趨熱過濾。
步驟3:向濾液中加入一定量(NH4)2SO4固體。
硫酸亞鐵晶體、硫酸銨、硫酸亞鐵銨晶體的溶解度(g/100 g H2O)
溫度物理溶解度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | 60 ℃ |
FeSO4·7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
(NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
(NH4)2SO4·FeSO4·6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
(1)步驟2中控制生成的硫酸亞鐵中不含硫酸鐵的方法是______________。
(2)在0~60 ℃內,從硫酸亞鐵和硫酸銨的混合溶液中可獲得硫酸亞鐵銨晶體的原因是_______________________________________________________。
(3)為了從步驟3所得溶液中獲得硫酸亞鐵銨晶體,操作是___________________________。
(4)測定硫酸亞鐵銨晶體中Fe2+含量的步驟如下:
步驟1:準確稱取a g(約為0.5 g)硫酸亞鐵銨晶體樣品,并配制成100 mL溶液。
步驟2:準確移取25.00 mL硫酸亞鐵銨溶液于250 mL錐形瓶中。
步驟3:立即用濃度約為0.1 mol·L-1 KMnO4溶液滴定至溶液呈穩定的粉紅色,即為滴定終點。
步驟4:將實驗步驟1~3重復2次。
①步驟1中配制100 mL溶液需要的玻璃儀器是___________________________________;
②為獲得樣品中Fe2+的含量,還需補充的實驗是_________________________________。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練 專題9非金屬元素及其化合物練習卷(解析版) 題型:填空題
氯氣是重要的化工原料。
(1)氯氣溶于水得到氯水,氯水中存在下列反應:Cl2+H2O??H++Cl-+HClO,其平衡常數表達式為K=________。
(2)工業上常用熟石灰和氯氣反應制取漂白粉,反應的化學方程式是____________________________。流程如下圖所示,其主要設備是氯化塔,塔從上到下分四層。將含有3%~6%水分的熟石灰從塔頂噴灑而入,氯氣從塔的最底層通入,這樣加料的目的是__________________________。處理從氯化塔中逸出氣體的方法是________。

(3)某科研小組在實驗室用較濃的KOH溶液直接吸收氯氣,研究發現反應進行一段時間后開始出現KClO3并逐漸增多,產生KClO3的離子方程式是____________________________________,其原因可能是__________________,由此可知(2)中氯化塔設計為四層是為了減少生產中類似副反應的發生。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練 專題8電化學基礎練習卷(解析版) 題型:填空題
電解法在金屬精煉、保護環境、處理廢水中起著十分重要的作用。
(1)下圖為電解精煉銀的示意圖,________(填a或b)極為含有雜質的粗銀,若b極有少量紅棕色氣體生成,則生成該氣體的電極反應式為________________________。

AgNO3—HNO3溶液
(2)電解法處理酸性含鉻廢水(主要含有Cr2O72-)時,以鐵板作陰、陽極,處理過程中存在反應Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。回答下列問題:
①寫出電極反應式:陰極________________,陽極________________。
②當生成1 mol Cr(OH)3時,電路中轉移電子的物質的量至少為________mol。
③電解過程中有Fe(OH)3沉淀生成,原因是_________________________________________________________________
________________________________________________________________。
(3)電解降解法可用于治理水中硝酸鹽的污染。電解降解NO3-的原理如圖所示。

①電源正極為________(填A或B),陰極反應式為________________________________________________________________。
②若電解過程中轉移了2 mol電子,則膜兩側電解液的質量變化差(Δm左-Δm右)為________g。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練 專題6化學反應速率和化學平衡練習卷(解析版) 題型:選擇題
在一密閉容器中,放入鎳粉并充入一定量的CO氣體,一定條件下發生反應:Ni(s)+4CO(g)  Ni(CO)4(g),已知該反應在25 ℃和80 ℃時的平衡常數分別為5×104、2,下列說法正確的是 ( )。
Ni(CO)4(g),已知該反應在25 ℃和80 ℃時的平衡常數分別為5×104、2,下列說法正確的是 ( )。
A.上述生成Ni(CO)4(g)的反應為吸熱反應
B.在80 ℃時,測得某時刻Ni(CO)4、CO濃度均為0.5 mol·L-1,則此時v(正)<v(逆)
C.恒溫恒壓下,向容器中再充入少量的Ar,上述平衡將正向移動
D.恒溫恒容下,向容器中再充入少量Ni(CO)4(g),達新平衡時,Ni(CO)4的百分含量將增大
查看答案和解析>>
科目:高中化學 來源:2013-2014學年高考化學二輪復習提分訓練 專題14實驗化學(選修)練習卷(解析版) 題型:選擇題
下列說法不正確的是( )。
A.利用分液漏斗進行分液操作時,先打開分液漏斗旋塞,使下層液體慢慢流出,待下層液體完全流出后,關閉旋塞,上層液體再從上面倒出
B.用玻璃棒蘸取新制氯水,滴在pH 試紙上,然后與比色卡對照,可測定新制氯水的pH
C.在用簡易量熱計測定反應熱時,可使用碎泡沫起隔熱保溫的作用、環形玻璃攪拌棒進行攪拌、酸和堿正好反應、取2~3 次的實驗平均值,以達到良好的實驗效果
D.固體藥品取用:塊狀固體用鑷子夾取,粉末狀的用藥匙或紙槽轉移
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com