
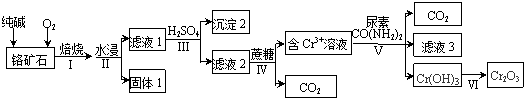
分析 以鉻礦石(主要成分是Cr2O3,含FeO、SiO2等雜質)為原料,加入碳酸鈉和氧氣高溫灼燒發生反應,二氧化硅能與碳酸鈉反應生成硅酸鈉,FeO被氧化為氧化鐵,水浸過濾分離,結合濾液2與蔗糖得到Cr3+、信息Cr2O72-+H2O?2CrO42-+2H+,可知濾液1中含有Na2CrO4、Na2SiO3、未反應的Na2CO3,過濾得到濾渣為氧化鐵,調節溶液pH使硅酸根轉化為硅酸沉淀,再過濾除去,得到濾液2中含有Na2Cr2O7、Na2SO4,用蔗糖還原,再與尿素反應,濾液3的主要溶質是兩種鹽為(NH4)2SO4、Na2SO4.
(1)增大接觸面積,升高溫度等可以反應速率;
(2)濾液1中含有Na2CrO4、Na2SiO3、Na2CO3等;
(3)根據電子轉移守恒計算Cr2O72-和蔗糖的物質的量之比;
(4)Cr3+沉淀完全的濃度為10-5mol/L,根據KSP[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.4×10-31計算c(OH-),根據水的離子積計算c(H+),再根據pH=-lgc(H+)計算;
(5)濾液3的主要溶質是兩種鹽是硫酸銨與硫酸鈉;
(6)將NaCrO2溶解后通入CO2得到更為純凈的Cr(OH)3,屬于水解反應,還生成碳酸氫鈉.
解答 解:以鉻礦石(主要成分是Cr2O3,含FeO、SiO2等雜質)為原料,加入碳酸鈉和氧氣高溫灼燒發生反應,二氧化硅能與碳酸鈉反應生成硅酸鈉,FeO被氧化為氧化鐵,水浸過濾分離,結合濾液2與蔗糖得到Cr3+、信息Cr2O72-+H2O?2CrO42-+2H+,可知濾液1中含有Na2CrO4、Na2SiO3、未反應的Na2CO3,過濾得到濾渣為氧化鐵,調節溶液pH使硅酸根轉化為硅酸沉淀,再過濾除去,得到濾液2中含有Na2Cr2O7、Na2SO4,用蔗糖還原,再與尿素反應,濾液3的主要溶質是兩種鹽為(NH4)2SO4、Na2SO4.
(1)適當升溫、粉碎鉻礦石、攪拌等等可以反應速率,
故答案為:適當升溫、粉碎鉻礦石、攪拌等;
(2)濾液1中含有Na2CrO4、Na2SiO3、Na2CO3等,除CO32-外,主要還有:CrO42-、SiO32-,
故答案為:CrO42-、SiO32-;
(3)反應中Cr元素化合價由+6價降低為+3價,C元素由0價升高為+4,根據電子轉移守恒則:6n(Cr2O72-)=48n(蔗糖),故n(Cr2O72-):n(蔗糖)=8:1
故答案為:8:1;
(4)Cr3+沉淀完全的濃度為10-5mol/L,根據KSP[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.4×10-31,可知c(OH-)=4×10-9mol/L,則c(H+)=$\frac{1{0}^{-14}}{4×1{0}^{-9}}$mol/L=$\frac{1}{4}$×10-5mol/L,則pH=-lg$\frac{1}{4}$×10-5=5.6,
故答案為:5.6;
(5)濾液3的主要溶質是兩種鹽是(NH4)2SO4、Na2SO4,
故答案為:(NH4)2SO4、Na2SO4;
(6)將NaCrO2溶解后通入CO2得到更為純凈的Cr(OH)3,屬于水解反應,還生成碳酸氫鈉,反應離子方程式為:CrO2-+CO2+2H2O=Cr(OH)3↓+HCO3-,
故答案為:CrO2-+CO2+2H2O=Cr(OH)3↓+HCO3-.
點評 本題考查物質制備工藝流程,涉及對操作與反應原理的分析評價、物質的分離提純、溶度積有關計算、化學計算計算等,側重于學生對原理的分析應用及計算能力的考查,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵粉溶于氯化鐵溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化鈉溶液呈堿性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工業上利用電解飽和食鹽水制氯氣:2H++2Cl-$\frac{\underline{\;通電\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 最高價氧化物水化物的堿性:Y<Z | B. | 簡單氣態氫化物的熱穩定性:X<W | ||
| C. | X分別與Z、W形成化合物的熔點:Z<W | D. | 簡單離子的還原性:X<W |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ag+、NO3-、Cl-、K+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液晶態介于晶體狀態和液態之間,液晶具有一定程度的晶體的有序性和液體的流動性 | |
| B. | 常壓下,0℃時冰的密度比水的密度小,水在4℃時密度最大,這些都與分子間的氫鍵有關 | |
| C. | 石油裂解、煤的干餾、玉米制醇、蛋白質的變性和納米銀粒子的聚集都是化學變化 | |
| D. | 單質硅是將太陽能轉變為電能的常用材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol•L-1KAl(SO4)2溶液中含0.2NA個SO42- | |
| B. | 常溫下,9gH2O含NA個O-H鍵 | |
| C. | 同溫同壓同體積的CO2、SO2所含氧原子數均為2NA | |
| D. | 32gCu與S完全反應轉移的電子數為NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com